
下列关于等离子体的叙述正确的是( )
A.物质一般有固态、液态和气态三态,等离子体被认为是物质存在的第四态
B.为了使气体变成等离子体,必须使其通电
C.等离子体通过电场时所有粒子的运动方向都发生改变
D.等离子体性质稳定,不易发生化学反应
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察。“玉兔”月球车底盘和车轮由铝合金材料制成。看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加。

(1)【知识回放】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Ag Pt Au。请你在横线上填写对应金属的元素符号。
(2)【作出猜想】
猜想1.Cr>Fe>Cu; 猜想2.Fe>Cu >Cr; 猜想3.你的猜想是 ____。
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(3)【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |
|
|
|
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | ______ |
(4)【结论与解释】
小聪得到的结论是:猜想 正确。
(5)【知识运用】
将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式 ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)·c(OH-)=
1×10-14
B.c(H+)等于1×10-7mol·L-1的溶液一定是中性溶液
C.0.2 mol·L-1CH3COOH溶液中的c(H+)是0.1 mol·L-1CH3COOH溶液中的c(H+)的2倍
D.任何浓度的溶液都可以用pH来表示其酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
在周期表主族元素中,甲元素与乙、丙、丁三种元素紧密相邻。这四种元素原子的最外层电子数之和为20;甲、丁的原子序数之和比乙、丙的原子序数之和大10;乙的原子序数小于丙。下列判断中不正确的是( )
A.甲的某种单质与丙的单质均可形成正四面体空间结构
B.四种原子半径:丙>乙>甲>丁
C.甲、乙、丙、丁四种单质的熔点最低的是乙
D.乙的氢化物与丁的氢化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题。
(1)C、Si、N元素的电负性由大到小的顺序是__________。C60和金刚石都是碳的同素异形体,二者相比较熔点较高的是__________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:__________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在纳米级的空间中,水的结冰温度是怎样的呢?为此,科学家对不同直径碳纳米管中水的结冰温度进行分析。下图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是____。
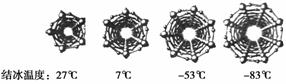
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物的物质的量相等,则消耗的Cl2为
A.0.5mol B.2mol C.2.5mol D.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
 请回答下列问题:
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”或“<”=)
SiC Si; SiCl4 SiO2
②右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体
的顶点用“●”表示出与之紧邻的硅原子。
③工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g) 该反应的反应热△H = kJ/mol.
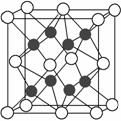 (2)化合物Na2O的晶胞如图。
(2)化合物Na2O的晶胞如图。
其中O2-离子的配位数为________,
该化合物与MgO相比,熔点较高的是________。(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为_____ ___g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com