
 X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.
X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.| 1 |
| 8 |
| 6+2 |
| 2 |
| 6-2 |
| 2 |
| 6-2 |
| 2 |


科目:高中化学 来源: 题型:
| A、33.6L(常温常压)氯气与2.7g铝充分反应,转移电子数为0.3NA |
| B、在标准状况下,22.4L CH2Cl2中含有的氢原子数为2NA |
| C、标准状况下,22.4L己烷含有的共价键数目为19NA |
| D、46gNO2气体在标准状况下的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯酚是一种弱酸,滴加指示剂变色 |
B、苯酚在水溶液中能按下式电离: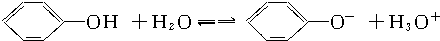 |
| C、苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性 |
| D、苯酚有腐蚀性,溅在皮肤上可用酒精冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
c(N
| ||
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).| n(CO2) |
| n(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、At2的颜色比I2深 |
| B、HAt的水溶液的酸性比盐酸强 |
| C、AgAt不溶于水 |
| D、HAt很稳定,受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | ||
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ?mol-1 | ||
C、已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为:H2(g)+
| ||
| D、25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ?mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为 H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com