
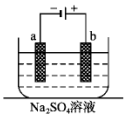
 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )| A. | 电子的流向:负极→a电极→b电极→正极 | |
| B. | a电极附近呈蓝色,b电极附近呈红色 | |
| C. | 逸出气体的体积,a电极的大于b电极的 | |
| D. | Na+向a极移动 |
分析 装置有外接电源是电解池,与电源正极相连的是阳极,与电源负极相连的是阴极,则b是阳极,a是阴极,电子从电源负极流出经导线流向阴极,在阴极上氢离子得电子生成氢气,阳极上氢氧根离子失电子生成氧气,电子沿导线流回电源正极,石蕊遇酸变红,遇碱变蓝,该装置实质是电解水,据此解答.
解答 解:A.电子不能通过溶液,故A错误;
B.a电极上氢离子放电,则a电极附近氢氧根离子浓度增大,溶液呈碱性,则变蓝色,b电极上氢氧根离子放电,导致b电极附近氢离子浓度增大,溶液呈酸性,则变红色,故B正确;
C.a电极上生成氢气,b电极上生成氧气,且二者的体积之比为2:1,故C正确;
D.电解时,阳离子向阴极a移动,故D正确;
故选A.
点评 本题考查电解池的工作原理,为高频考点,侧重分析与应用能力的考查,注意离子的移动方向,明确阴阳极上放电的离子是解本题关键,难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:解答题
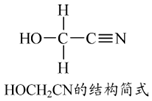 锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题:
锌是人体必需的微量元素,明朝(天工开物)中有世界上最早的关于炼锌技术的记载.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、H2SO4、(NH4)2SO4 | B. | Ba(OH)2、Na2SO4、Na3PO4 | ||
| C. | Na2CO3、HNO3、MgO | D. | HCl、Al2O3、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Cu>Na | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱:S>C | |
| D. | F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | M与T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | L2+与R2-的核外电子数相等 | |
| D. | 单质分别与浓度相等的稀盐酸反应的速率为Q>L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的熔、沸点比ⅦA族其他元素氢化物的高 | |
| B. | 水分子高温下也很稳定 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | NH3极易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com