
某化学小组探究液体有机物样品A(C3 H8 O2)的结构,进行如下实验。
实验I:用右图实验装置,通过Na与A反应确定羟基个数。
试回答下列问题:
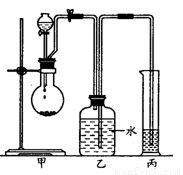
(1)有机物A从 (填仪器名称)中加入;检验装置甲的气密性的方法是 。
(2)实验前预先将小块钠在二甲苯中熔化成若干个小球并冷却后再与有机物A反应,其目的是 。
(3)实验数据记录如下:p=l.038 g·mL-1
|
实验编号 |
有机样品的体积 |
有机样品的质量 |
生成气体的体积(标准状况下) |
|
I |
3.65mL |
3.8g |
1120mL |
|
II |
7.30mL |
7.6g |
2240mL |
|
III |
14.60mL |
15.2g |
4000mL |
①不能选第组数据来计算A中羟基个数,这组数据出现错误的原因可能是 ,(填两条)。
②有机物A中羟基个数为 。
实验Ⅱ:
欲确定有机物A中含氧官能团的位置,进行如下实验:
①取7.30 mL A,Cu作催化剂,经氧化后完全转化成液态有机物B。
②取一质量为m1g的洁净试管,向其中加入足量银氨溶液,滴人化合物B,并水浴加热,待充分反应后,静置,小心倒出上层清液,向试管中小心滴加蒸馏水,倒出,再加入蒸馏水,再倒出,最后将试管烘干并称量。重复2次,试管质量均为m2g。
试回答下列问题:
(1)步骤②中小心滴加蒸馏水的目的是 。
(2)若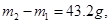 则有机物A的结构简式是
。
则有机物A的结构简式是
。
(3)步骤②中,不宜将银氨溶液换成新制氢氧化铜溶液的原因是 。
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
(2011?泰州一模)某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验: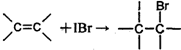
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:
市场上一种新型洗涤剂的主要化学成分是两种常见物质固体A和液体B形成的白色结晶化合物,某化学小组对该洗涤进行探究,实验过程如下:
(1)提出问题:该洗涤剂中A和B各是什么?它们的配比如何?
(2)定性实验探究:
| 序号 | 主要操作步骤 | 主要实验现象 | 结论 |
| ① | 取少量洗涤剂,加水溶解,用洁净的铂丝蘸取溶液,在酒精灯火焰上灼烧 | 火焰呈黄色 | 洗涤剂中含Na+ |
| ② | 取溶液1-2mL于试管中,滴入酚酞溶液,振荡,然后加入MnO2粉末少许,并将带火星的木条伸入试管内 | 溶液先变红,后逐渐褪色;气泡冒出剧烈,木条复燃 | A为______ B为_______ |
| ③ | 取②上层清液少许,加入足量稀硫酸,将燃着的木条伸入试管内;另取②上层清液少许,滴入稀MgCl2溶液 | 有无色无味气体放出,木条火焰熄灭,有白色沉淀生成 |
(3)定量实验探究:为测定洗涤剂中A和B的配比,请从下图中选择适当的仪器,组装一套测定某物理量的最简便的装置,该装置的连接顺序从左至右是(填各接口的字母代号)____________,测定的物理量是____________,欲达实验目的还必须知道的物理量是____________。(4)根据该结晶化合物的性质,你认为在储存和使用该洗涤剂时应注意的问是 (写出任意一点即可)。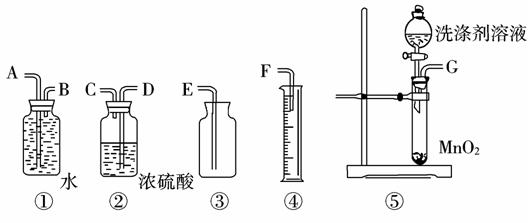
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com