

 ;
; 、和
、和 ;
; .
. 分析 B可在NaOH乙醇溶液加热的条件下反应生成A,则A中含有C=C,有机物A为烃类化合物,质谱图表明其相对分子质量为70,根据商余法,$\frac{70}{14}$=5,则A的分子式为C5H10,B的分子式为C5H11Br,D能与银氨溶液反应,说明D中含有-CHO,E中含有-COOH,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,说明含有4种不同的H原子,D应为 CH3-CH(CH3)-CH2-CHO,E应为 CH3-CH(CH3)-CH2-COOH,C为 CH3-CH(CH3)-CH2-CH2OH,B为CH3-CH(CH3)-CH2-CH2Br,则A为CH3-CH(CH3)-CH=CH2,结合有机物的结构和性质解答该题.
(1)D应为 CH3-CH(CH3)-CH2-CHO,据此书写分子式;
(2)E应为 CH3-CH(CH3)-CH2-COOH,根据结构简式解答;
(3)有机物加氢的反应为还原反应;
(4)D与新制氢氧化铜悬浊液反应,D中醛基被氧化成羧基;
(5)C为 CH3-CH(CH3)-CH2-CH2OH,E应为 CH3-CH(CH3)-CH2-COOH,酸脱羟基醇脱氢,发生酯化反应;
(6)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,则它们的结构简式为 、
、 ;
;
(7)能发生银镜反应,说明含有醛基,能与足量金属钠生成氢气,不能发生消去反应,说明含有-OH,且与羟基相连的碳上没有氢原子.
解答 解:B可在NaOH乙醇溶液加热的条件下反应生成A,则A中含有C=C,有机物A为烃类化合物,质谱图表明其相对分子质量为70,根据商余法,$\frac{70}{14}$=5,则A的分子式为C5H10,B的分子式为C5H11Br,D能与银氨溶液反应,说明D中含有-CHO,E中含有-COOH,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,说明含有4种不同的H原子,D应为 CH3-CH(CH3)-CH2-CHO,E应为 CH3-CH(CH3)-CH2-COOH,C为 CH3-CH(CH3)-CH2-CH2OH,B为CH3-CH(CH3)-CH2-CH2Br,则A为CH3-CH(CH3)-CH=CH2,
(1)由以上分析可知D为CH3-CH(CH3)-CH2-CHO,分子式为C5H10O,故答案为:C5H10O;
(2)E为 CH3-CH(CH3)-CH2-COOH,所含官能团-COOH,名称为羧基,故答案为:羧基;
(3)反应Ⅲ是D物质(CH3)2CHCH2CHO与氢气发生加成反应生成C物质(CH3)2CHCH2CH2OH,也属于还原反应,故答案为:ab;
(4)D与新制氢氧化铜悬浊液反应,D中醛基被氧化成羧基,反应方程式为(CH3)2CHCH2CHO+2Cu(OH)2→Cu2O↓+2H2O+(CH3)2CHCH2COOH,
故答案为:(CH3)2CHCH2CHO+2Cu(OH)2→Cu2O↓+2H2O+(CH3)2CHCH2COOH;
(5)C和E可在一定条件下反应生成F,F为有香味的有机化合物,发生酯化反应,酸脱羟基醇脱氢,所以该反应的化学方程式为:
故答案为: ;
;
(6)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,则它们的结构简式为 、
、 ,
,
故答案为: 、
、 ;
;
(7)(CH3)2CHCH2COOH的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,含有-CHO与-OH,且不能发生消去反应,其结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,涉及卤代烃、醇、醛、羧酸的性质与转化,计算确定A的分子式是关键,再结合反应条件进行推断,侧重考查学生分析推理能力,熟练掌握常见官能团的结构及其性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-)的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1H2CrO4溶液的pH=1 | |
| B. | 向100 mL0.l mol•L-1 H2CrO4溶液中滴入几滴NaOH溶液,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$变大 | |
| C. | Na2CrO4溶液中:c(Na+)+c(H+)=c(CrO42-)+c(HCrO4-)+c(OH-) | |
| D. | 等浓度的:NaHCrO4溶液与NaHCO3溶液中,水的电离程度前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
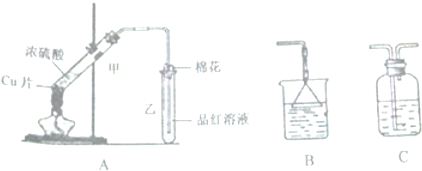
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
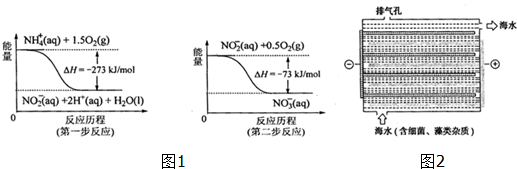
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
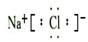 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com