
¹¤ŅµÉĻ²ÉÓĆNH3×÷»¹Ō¼ĮĶѵŖŌĄķĪŖ£ŗ
NO(g)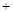 NO2(g)
NO2(g)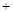 2NH3(g)
2NH3(g)  2N2(g)
2N2(g)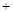 3H2O(g)£¬
3H2O(g)£¬
ŃĢĘųŅŌŅ»¶ØµÄĮ÷ĖŁĶعż£¬²āĮæ²»Ķ¬ĪĀ¶ČĻĀŅŻ³öĘųĢåÖŠµŖŃõ»ÆĪļŗ¬Į棬“Ó¶ųČ·¶ØŃĢĘųŠ§ĀŹ£¬ÓŅĶ¼ŹĒĮ½ÖÖ²»Ķ¬“߻ƼĮµÄĶѵŖŠ§ĀŹĒśĻߣ¬ÅŠ¶ĻŅŌĻĀ·ÖĪöÕżČ·µÄŹĒ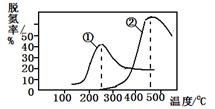
| A£®ÉĻŹö·“Ó¦µÄÕż·“Ó¦ĪŖĪüČČ·“Ó¦ |
| B£®“߻ƼĮ¢Ł”¢¢Ś·Ö±šŹŹŗĻÓŚ250”ęŗĶ450 ”ę×óÓŅĶѵŖ |
| C£®ĒśĻߢŁ”¢¢Ś×īøßµć±ķŹ¾“ĖŹ±Ę½ŗā×Ŗ»ÆĀŹ×īøß |
| D£®ĻąĶ¬Ģõ¼žĻĀ£¬øıäŃ¹Ēæ¶ŌĶѵŖĀŹĆ»ÓŠÓ°Ļģ |
B
½āĪöŹŌĢā·ÖĪö£ŗÓÉÓŚ·“Ó¦ĪŖ£ŗNO(g) + NO2(g) + 2NH3(g) 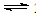 2N2(g) + 3H2O(g)£¬ÓÉĶ¼ĻńæÉÖŖ£¬ĻąĶ¬Ģõ¼žĻĀ£¬æŖŹ¼Ź±ĖęĪĀ¶ČµÄÉżøßĶѵŖĀŹÖš½„Ōö“ó£¬ŗóĖęĪĀ¶ČµÄÉżøßĶѵŖĀŹÖš½„¼õŠ”£»×īøßµć±ķŹ¾“ļµ½Ę½ŗāדĢ¬£¬Ę½ŗāŗóŌŁÉżøßĪĀ¶ČĶѵŖĀŹ·“¶ųŹĒ¼õŠ”µÄ£¬ĖłŅŌ£¬øĆ·“Ó¦µÄÕż·“Ó¦·½ĻņĪŖ·ÅČČ·“Ó¦£¬A“ķ£»øĆ·“Ó¦ĪŖ·ĒµČĢå»ż·“Ó¦£¬Ń¹ĒæµÄøıä±ŲŠė»įÓ°ĻģĶѵŖĀŹ£¬ĖłŅŌD“ķ£»ĒśĻߢŁ”¢¢Ś×īøßµć±ķŹ¾·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬C“ķ£»ÓÉĶ¼ŠĪ·ÖĪöæÉÖŖ“߻ƼĮ¢Ł”¢¢Ś·Ö±šŹŹŗĻÓŚ250”ęŗĶ450”ę×óÓŅĶѵŖ£¬BÕżČ·£»
2N2(g) + 3H2O(g)£¬ÓÉĶ¼ĻńæÉÖŖ£¬ĻąĶ¬Ģõ¼žĻĀ£¬æŖŹ¼Ź±ĖęĪĀ¶ČµÄÉżøßĶѵŖĀŹÖš½„Ōö“ó£¬ŗóĖęĪĀ¶ČµÄÉżøßĶѵŖĀŹÖš½„¼õŠ”£»×īøßµć±ķŹ¾“ļµ½Ę½ŗāדĢ¬£¬Ę½ŗāŗóŌŁÉżøßĪĀ¶ČĶѵŖĀŹ·“¶ųŹĒ¼õŠ”µÄ£¬ĖłŅŌ£¬øĆ·“Ó¦µÄÕż·“Ó¦·½ĻņĪŖ·ÅČČ·“Ó¦£¬A“ķ£»øĆ·“Ó¦ĪŖ·ĒµČĢå»ż·“Ó¦£¬Ń¹ĒæµÄøıä±ŲŠė»įÓ°ĻģĶѵŖĀŹ£¬ĖłŅŌD“ķ£»ĒśĻߢŁ”¢¢Ś×īøßµć±ķŹ¾·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬C“ķ£»ÓÉĶ¼ŠĪ·ÖĪöæÉÖŖ“߻ƼĮ¢Ł”¢¢Ś·Ö±šŹŹŗĻÓŚ250”ęŗĶ450”ę×óÓŅĶѵŖ£¬BÕżČ·£»
æ¼µć£ŗ±¾ĢāÖ÷ŅŖæ¼²éøł¾ŻĶ¼Ļń·ÖĪö×Ŗ»ÆĀŹ¼°·“Ó¦ČČ£¬Ę½ŗāŅʶÆĒéæö”£


 ĆūŠ£æĪĢĆĻµĮŠ“š°ø
ĆūŠ£æĪĢĆĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠ·“Ó¦ÖŠÉś³ÉĪļµÄ×ÜÄÜĮæ“óÓŚ·“Ó¦Īļ×ÜÄÜĮæµÄ·ĒŃõ»Æ»¹Ō·“Ó¦ŹĒ
| A£®ĀĮČČ·“Ó¦ | B£®ĀČ»ÆĀĮČÜŅŗµÄĖ®½ā |
| C£®ĒāŃõ»ÆÄĘŗĶŃĪĖį·“Ó¦ | D£®½¹ĢæŌŚøßĪĀĻĀÓėĖ®ÕōĘų·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ėĀ(N2H4)ŹĒŅ»ÖÖæÉÓĆÓŚ»š¼ż»ņŌµē³ŲµÄČ¼ĮĻ”£ŅŃÖŖ£ŗ
N2(g) + 2O2(g) £½2 NO2(g) ¦¤H =" +67.7kJ/mol" ””””””””””””””””””””¢Ł
N2H4(g) + O2(g) £½ N2(g) + 2H2O(g)””¦¤H = £534 kJ/mol ¢Ś
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
| A£®·“Ó¦¢ŁÖŠ·“Ó¦ĪļĖł¾ßÓŠµÄ×ÜÄÜĮæ“óÓŚÉś³ÉĪļĖł¾ßÓŠµÄ×ÜÄÜĮæ |
| B£®2N2H4(g) + 2NO2(g) £½ 3N2(g)+ 4H2O (g) ¦¤H = £1000.3kJ/mol”” |
| C£®²¬×öµē¼«£¬KOHČÜŅŗ×öµē½āÖŹČÜŅŗ£¬ÓÉ·“Ó¦¢ŚÉč¼ĘµÄČ¼ĮĻµē³ŲĘäøŗ¼«·“Ó¦Ź½£ŗN2H4£4e£+4OH££½N2+4H2O |
| D£®²¬×öµē¼«£¬KOHČÜŅŗ×öµē½āÖŹČÜŅŗ£¬ÓÉ·“Ó¦¢ŚÉč¼ĘµÄČ¼ĮĻ£¬¹¤×÷Ņ»¶ĪŹ±¼äŗó£¬KOHČÜŅŗµÄpH½«Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŌĻĀ¹ŲÓŚĻĀĶ¼Ėµ·ØÕżČ·µÄŹĒ
| A£®ČēĶ¼±ķĆ÷“߻ƼĮæÉŅŌøı䷓ӦµÄČČŠ§Ó¦ |
| B£®ČēĶ¼±ķŹ¾Ä³·“Ó¦ÄÜĮæµÄ±ä»ÆÓėÉś³ÉĪļדĢ¬ĪŽ¹Ų |
| C£®ČēĶ¼±ķŹ¾Ä³ĪüČČ·“Ó¦·Ö±šŌŚÓŠ”¢ĪŽ“߻ƼĮµÄĒéæöĻĀ·“Ó¦¹ż³ĢÖŠµÄÄÜĮæ±ä»Æ |
| D£®ČēĶ¼±ķĆ÷»Æѧ·“Ó¦²»½ö×ńŃÖŹĮæŹŲŗć¶ØĀÉ£¬Ņ²×ńŃÄÜĮæŹŲŗć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ČēĻĀĶ¼ĖłŹ¾£¬”÷H1=£393.5 kJ?mol-1£¬”÷H2=£395.4 kJ?mol-1£¬ĻĀĮŠĖµ·Ø»ņ±ķŹ¾Ź½ÕżČ·µÄŹĒ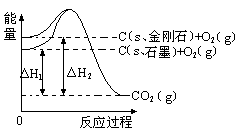
| A£®ŹÆÄ«ŗĶ½šøÕŹÆµÄ×Ŗ»ÆŹĒĪļĄķ±ä»Æ |
| B£®1molŹÆÄ«µÄ×ÜÄÜĮæ±Č1 mol½šøÕŹÆµÄ×ÜÄÜĮæ“ó1.9 kJ |
| C£®½šøÕŹÆµÄĪČ¶ØŠŌĒæÓŚŹÆÄ« |
| D£®C(s”¢ŹÆÄ«)=C(s”¢½šøÕŹÆ) ”÷H=" +1.9" kJ?mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
½«1000 mL 0£®1 mol”¤L£1 BaCl2ČÜŅŗÓė×ćĮæĻ”ĮņĖį³ä·Ö·“Ó¦·Å³öa kJČČĮ棻½«1000 mL 0£®5 mol”¤L£1 HClČÜŅŗÓė×ćĮæCH3COONaČÜŅŗ³ä·Ö·“Ó¦·Å³öb kJČČĮæ(²»æ¼ĀĒ“×ĖįÄĘĖ®½ā)£»½«500 mL 1 mol”¤L£1 H2SO4ČÜŅŗÓė×ćĮæ(CH3COO)2Ba(æÉČÜŠŌĒæµē½āÖŹ)ČÜŅŗ·“Ó¦·Å³öµÄČČĮæĪŖ
| A£®(5a£2b) kJ | B£®(2b£5a) kJ |
| C£®(5a£«2b) kJ | D£®(10a£«4b) kJ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŌŚĶ¬ĪĀĶ¬Ń¹ĻĀ,ĻĀĮŠø÷×éČČ»Æѧ·½³ĢŹ½ÖŠ£¬”÷H2>”÷H1µÄŹĒ
| A£®S(g)+O2(g)£½SO2(g)£¬”÷H1£» S(s)+O2(g)£½SO2(g)£¬”÷H2 |
| B£®2H2(g)+O2(g)£½2H2O(g)£¬”÷H1£» 2H2(g)+O2(g)£½2H2O(l)£¬”÷H2 |
C£®C(s)+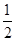 O2(g)=CO(g)”÷H1£»C(s)+O2(g)=CO2(g)”÷H2 O2(g)=CO(g)”÷H1£»C(s)+O2(g)=CO2(g)”÷H2 |
| D£®H2(g)+Cl2(g)£½2HCl(g)£¬”÷H1£» 2H2(g)+2Cl2(g)£½4HCl(g)£¬”÷H2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ĻĀĮŠĪļÖŹŠŌÖŹµÄ±ä»Æ¹ęĀÉ£¬Óė¹²¼Ū¼üµÄ¼üÄÜ“óŠ”ĪŽ¹ŲµÄŹĒ£Ø £©
¢ŁF2”¢Cl2”¢Br2”¢I2µÄČŪµć”¢·ŠµćÖš½„Éżøß ¢ŚHF”¢HCl”¢HBr”¢HIµÄČČĪČ¶ØŠŌŅĄ“Ī¼õČõ
¢Ū½šøÕŹÆ”¢Ģ¼»Æ¹č”¢¾§Ģå¹čČŪµćÖš½„½µµĶ ¢ÜNaF”¢NaCl”¢NaBr”¢NaIµÄČŪµćŅĄ“Ī½µµĶ
| A£®½ö¢Ś | B£®¢Ł¢Ü | C£®¢Ś¢Ū | D£®¢Ł¢Ś¢Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗµ„Ń”Ģā
ŅŃÖŖ£ŗ¢Ł1 mol H2·Ö×ÓÖŠ»Æѧ¼ü¶ĻĮŃŹ±ŠčŅŖĪüŹÕ436 kJµÄÄÜĮæ””¢Ś1 mol Cl2·Ö×ÓÖŠ»Æѧ¼ü¶ĻĮŃŹ±ŠčŅŖĪüŹÕ243 kJµÄÄÜĮæ””¢ŪÓÉHŌ×ÓŗĶClŌ×ÓŠĪ³É1 mol HCl·Ö×ÓŹ±ŹĶ·Å431 kJµÄÄÜĮ攣ĻĀĮŠŠšŹöÕżČ·µÄŹĒ (””””)”£
| A£®ĒāĘųŗĶĀČĘų·“Ӧɜ³ÉĀČ»ÆĒāĘųĢåµÄČČ»Æѧ·½³ĢŹ½ŹĒH2(g)£«Cl2(g)===2HCl(g) |
| B£®ĒāĘųŗĶĀČĘų·“Ӧɜ³É2 molĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ¦¤H£½£«183 kJ”¤mol£1 |
| C£®ĒāĘųŗĶĀČĘų·“Ӧɜ³É2 molĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ¦¤H£½£183 kJ”¤mol£1 |
| D£®ĒāĘųŗĶĀČĘų·“Ӧɜ³É1 molĀČ»ÆĒāĘųĢ壬·“Ó¦µÄ¦¤H£½£«183 kJ”¤mol£1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com