
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)  Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
A.溶液中钙离子数目减小
B.溶液中钙离子浓度减少
C.溶液中氢氧根离子浓度增大
D.pH减小
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年陕西西藏民族学院附中高二下期末化学卷(解析版) 题型:选择题
室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
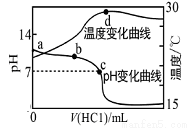
A.将此氨水稀释,溶液的导电能力减弱
B.b点溶液中离子浓度大小可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c点时消耗盐酸体积V(HCl)<20.00mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市高二下学期期末化学试卷(解析版) 题型:简答题
海水的综合利用包括很多方面,下图是从海水中通过一系列工艺流程提取产品的流程图。
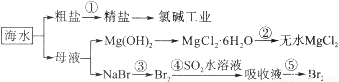
海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。回答下列问题:
(1)海水pH约为8的原因主要是天然海水含上述离子中的_________。
(2)除去粗盐溶液中的杂质(Mg2+、SO42-、Ca2+),加入药品的顺序可以为__________(填序号)
①NaOH溶液 ②BaCl2溶液 ③过滤后加盐酸 ④Na2CO3溶液
(3)过程②中由MgCl2·6H2O制得无水MgCl2,应如何操作____________________。
(4)从能量角度来看,氯碱工业中的电解饱和食盐水是一个将__________转化为_________的过程。采用石墨阳极,不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为_____________
(5)从第③步到第④步的目的是____________________。采用“空气吹出法”从浓海水中吹出Br2,并用SO2吸收。主要反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省秦皇岛市卢龙县高二下学期期末化学试卷(解析版) 题型:填空题
若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本堆积方式中的 。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省秦皇岛市卢龙县高二下学期期末化学试卷(解析版) 题型:选择题
可通过实验来验证淀粉水解生成还原性糖,其实验包括下列一些操作过程,这些操作过程的正确排列顺序是

①取少量淀粉加水制成溶液
②加热煮沸
③加入碱液,中和并呈碱性
④加入新制的Cu(OH)2悬浊液
⑤加入几滴稀H2SO4
⑥再加热
A.①②⑤⑥④③ B.①⑤②③④⑥
C.①⑤②④⑥③ D.①⑥④⑤③②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省秦皇岛市卢龙县高二下学期期末化学试卷(解析版) 题型:选择题
化学与社会、生活、生产密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解释 |
A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
B | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
D | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省秦皇岛市卢龙县高二下学期期末化学试卷(解析版) 题型:选择题
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是
A.HClO的电子式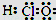
B.比例模型 :可以表示CH4,也可以表示CCl4
:可以表示CH4,也可以表示CCl4
C.乙烯的结构简式:CH2CH2
D.碳酸氢根电离:HCO3-  H++CO32-
H++CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省太原市高一下学期期末化学试卷(解析版) 题型:选择题
将甲烷和氯气混合后,在光照条件下按右图装置进行实验,下列说法中正确的是
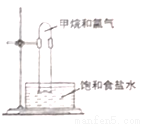
A.此反应属于加成反应
B.此反应无光照也可发生
C.用此方法可制备纯净的CH3Cl
D.一段时间后试管内壁出现油状液滴
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄香、航天等校高二下学期期末联化学试卷(解析版) 题型:填空题
有可逆反应Fe(s)+CO2(g) 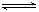 FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了
B.C(CO)不变了
C.v正(CO2)=v逆(CO)
D.C(CO2):c(CO)=1:1
(2)该反应的逆反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。①升高温度__________;②再通入CO___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com