
【题目】常温下,下列物质与水混合后静置,出现分层的是( )
A. 氯化氢 B. 乙醇 C. 苯 D. 乙酸
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氨气是一种重要化合物,在工农业生产、生活中有着重要作用。
(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
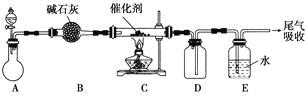
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是________。
②C装置中发生反应的化学方程式为________________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是________,试设计实验证明这种离子的存在_____________________。
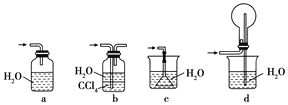
④下列哪些装置可以同时起到装置D和E的作用________(填代号)。
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________________(不必配平),该反应生成的还原产物的化学键类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢(H2O2)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。H2O2能与SO2反应生成H2SO4, H2O2的分子结构如图所示。下列说法错误的是( )

A. H2O2的结构式为H—O—O—H
B. H2O2为含有极性键和非极性键的共价化合物
C. 与SO2在水溶液中反应的离子方程式为SO2+ H2O2=2H++SO42-
D. H2O2与SO2反应过程中有共价键断裂,同时有共价键和离子键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应 3A(g)+2B(g)![]() zC(g)+2D(g)。在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6 mol C,又测得D的反应速率v(D)= 0.2 mol.L-1min-1。则下列说法不正确的是( )
zC(g)+2D(g)。在2L的密闭容器中把4molA和2molB混合,2min后反应达到平衡时生成1.6 mol C,又测得D的反应速率v(D)= 0.2 mol.L-1min-1。则下列说法不正确的是( )
A. z=4B. B的转化率是40%
C. A的平衡浓度是1.4mol.L-1D. 平衡时气体压强是原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多原子分子中各原子若在同一平面,且有2个以上相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,下列物质中存在“离域π键”的是( )
A.SO2B.PO43-C.H2SD.HCHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是:
A. 化学反应速率理论是研究怎样在一定时间内快出产品
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学反应速率理论是研究怎样提高原料转化率
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com