
| A. | 最外层电子数:W>Z | B. | 气态氢化物的稳定性:X<Z | ||
| C. | 最高价氧化物对应水物的碱性:Y<W | D. | Y、Z的氧化物都是两性氧化物 |
分析 X、Y、Z、W为元素周期表中前20号元素,原子序数依次增大、W、Y为金属元素,X原子的最外层电子数是其核外电子数总数的$\frac{3}{4}$倍,则X含有8个电子,最外层电子数为6,即X为O元素;Z单质是制造太阳能电池的主要材料之一,则Z为Si元素;Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,而且W、Y为金属元素,则Y为Al元素,W为K元素;据此结合元素化合物的性质和元素周期律解答.
解答 解:X、Y、Z、W为元素周期表中前20号元素,原子序数依次增大、W、Y为金属元素,X原子的最外层电子数是其核外电子数总数的$\frac{3}{4}$倍,则X含有8个电子,最外层电子数为6,即X为O元素;Z单质是制造太阳能电池的主要材料之一,则Z为Si元素;Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,而且W、Y为金属元素,则Y为Al元素,W为K元素;
A.W为K元素,Z为Si元素,最外层电子数:Z>W,故A错误;
B.元素的非金属性越强,其氢化物越稳定,非金属性:O>Si,则气态氢化物的稳定性:X>Z,故B错误;
C.元素的金属性越强,其最高价氧化物对应水物的碱性越强,金属性:K>Al,所以最高价氧化物对应水物的碱性:Y<W,故C正确;
D.Z为Si元素,其氧化物为酸性氧化物,故D错误.
故选C.
点评 本题考查原子结构与元素周期律知识,侧重于学生的分析能力的考查,难度中等,注意把握原子结构特征和对应单质、化合物的性质,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 向醋酸溶液中通入少量HCl(g),溶液中c(H+)/c(CH3COOH)增大 | |
| B. | pH=8的NaHS的溶液中,c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-) | |
| C. | 0.1mol/L盐酸与0.1mol/L氨水等体积混合后的溶液中:c(OH-)>c(H+)+c(NH3•H2O) | |
| D. | 某CH3COONa溶液的pH=b,其中由水电离出的c(H+)=10b-14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
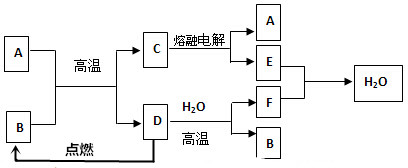
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
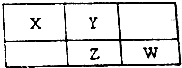
| A. | 原子半径Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W | |
| C. | 四种元素的单质中,Z单质的熔、沸点最高 | |
| D. | Z的单质与足量的单质Y反应,直接得到一种ZY3的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在某弱酸HA溶液中加入NaA固体后,$\frac{c(HA)•c(O{H}^{-})}{c({A}^{-})}$减小 | |
| B. | 将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+c(HCO3-)=0.1 mol•L-1 | |
| C. | 常温下,0.1 mol•L-1的NH4HCO3溶液其pH=7.8,则Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | 已知常温低下Ksp(AgI)=2.0×10-16,在AgI悬浊液中加入少量KI粉末,AgI(s)?Ag+(aq)+I-(aq)平衡向左移动,溶液中离子的总浓度会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
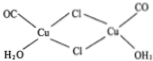 镍和铜都是重要的有色金属材料,回答下列问题:
镍和铜都是重要的有色金属材料,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
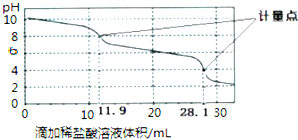
| A. | 此样品中NaHCO3的物质的量为(28.1-11.9)×10-4mol | |
| B. | 整个滴定过程中,溶液中阴离子总数始终不变 | |
| C. | 滴加稀盐酸的体积为11.90mL时:c(H+)+c(H2CO3)═c(OH-)+c(CO32-) | |
| D. | 该方法无法测定Na2CO3和NaOH混合溶液中NaOH的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,NH4Cl溶液加水稀释过程中,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$数值增大 | |
| B. | O.lOOOmol•L-1 的醋酸钠溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000mol•L-1 | |
| C. | 室温下,0.1mol•L-1NaHCO3溶液的pH=8.31,则Ka1(H2CO3)×Ka2(H2CO3)<K | |
| D. | 室温,Ka(CH3COOH)=l.76×l0-5,Kb(NH3•H2O)=1.76×lO-5.则CH3COONH4溶液中存在:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-)>c(NH3•H2O)=c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
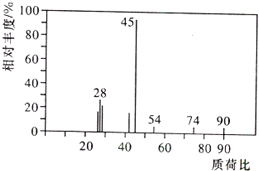 有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.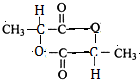 +2H2O;
+2H2O;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com