
| A、相同质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下Na2CO3产生的CO2体积大 |
| B、将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生沉淀 |
| C、向Na2CO3饱和溶液中通入足量的CO2会有NaHCO3晶体析出 |
| D、Na2CO3中含少量NaHCO3,可用加热法除去 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
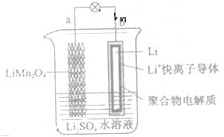 水锂电是当今锂电池研发的前沿和方向之一,理论上水锂电能量密度大,能量效率高达95%.关于如图所示的水溶液锂离子电池体系的叙述正确的是( )
水锂电是当今锂电池研发的前沿和方向之一,理论上水锂电能量密度大,能量效率高达95%.关于如图所示的水溶液锂离子电池体系的叙述正确的是( )| A、a为电池的负极 |
| B、放电时,a极锂的化合价发生变化 |
| C、放电时,溶液中Li+从b向a迁移 |
| D、电池充电反应为Li1-xMn2O4+xLi═LiMn2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(NH4)2Fe(SO4)2溶液中:c(SO42-)>c(Fe2+)>c(NH4+)>c(H+)>c(OH-) |
| B、PH相等的①CH3COONa②NaAlO2溶液比较:c(Na+):①<② |
| C、NH4HSO4溶液中:c(H+)>c(OH-)+c(SO42-) |
| D、NaAlO2溶液中通入过量CO2后:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
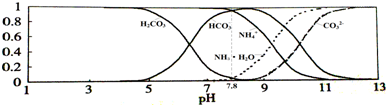
| A、NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3?H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| C、通过分析可知常温下Kb(NH3?H2O)>Ka1(H2CO3) |
| D、当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3?H2O)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、CO过量 |
| B、CO与铁矿石接触不充分 |
| C、炼铁高炉的高度不够 |
| D、CO与的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | Ba(OH)2的体积/mL | 溶液的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com