


科目:高中化学 来源: 题型:
| A、为提高高锰酸钾的氧化能力,用盐酸酸化 | B、为确认某溶液中含有SO42-时,用盐酸酸化,再检验 | C、为检验某氯代烷烃中含氯,加碱溶液加热后用稀硫酸酸化,再检验 | D、为抑制Fe2+ 的水解,用稀硝酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加快化石燃料的开采与使用,有利于节能减排、保护环境 | ||
| B、河流入海口三角洲的形成与胶体的聚沉有关 | ||
C、催化法处理汽车尾气的原理可表示为:CO+NO
| ||
| D、橄榄油中含有大量的不饱和油脂,能抗氧化,可以大量食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、②④⑤ | C、①③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂为HI | B、反应产物中能使淀粉变蓝的物质有I2、NaI | C、该反应中氧化剂与还原剂物质的量之比为1:1 | D、人误食亚硝酸钠中毒时,可以服用HI溶液解毒 |
查看答案和解析>>
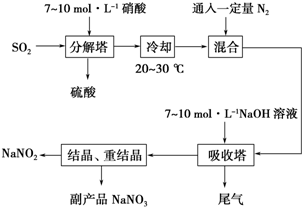
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中3个碳原子在同一直线上 | B、分子中所有原子在同一平面上 | C、与氯化氢加成只生成一种产物 | D、能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com