
【题目】<1>、已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
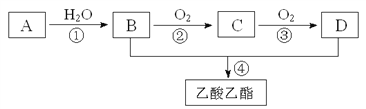
回答下列问题:
(1)写出A的电子式:_________,C的结构简式:____________。
(2)B、C分子中的官能团名称分别__________、___________。
(3)写出下列反应的化学方程式及反应类型。
反应①:___________________________________反应类型:_________________ ;
反应② ___________________________________反应类型:_________________ ;
反应④ ___________________________________反应类型:__________________。
<2>、在实验室可以在试管a中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL 乙酸,按下图所示(挟持和加热仪器略去)连接好装置进行实验,以制取乙酸乙酯。回答下列问题:
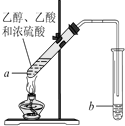
(1)浓硫酸的主要作用是①________,②________。
(2)试管b中盛放的溶液是________,b中通蒸气的导管不能插入溶液中目的是________________。
(3)做此实验时,有时还向a试管里加入几块碎瓷片,其目的是________。
【答案】 ![]() CH3CHO 羟基 醛基 CH 2 =CH 2 +H 2 O
CH3CHO 羟基 醛基 CH 2 =CH 2 +H 2 O![]() CH 3 CH 2 OH 加成反应
CH 3 CH 2 OH 加成反应 ![]() 氧化反应
氧化反应 ![]() 酯化或取代反应 催化剂 吸水剂 饱和Na 2 CO3 溶液 防止倒吸 防止爆沸
酯化或取代反应 催化剂 吸水剂 饱和Na 2 CO3 溶液 防止倒吸 防止爆沸
【解析】《1》A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,A和水发生加成反应生成B,B为CH3CH2OH,B和D发生酯化反应生成乙酸乙酯,则D为CH3COOH,C为CH3CHO;
(1)A是乙烯,A的电子式为![]() ,C的结构简式为CH3CHO;
,C的结构简式为CH3CHO;
(2)B为CH3CH2OH,C为CH3CHO,B、C分子中的官能团名称分别醇羟基、醛基;
(3)①为乙醇和水的加成反应,反应方程式为:CH2=CH2+H2O![]() CH3CH2OH,属于加成反应;②为乙醇的催化氧化反应,反应方程式为
CH3CH2OH,属于加成反应;②为乙醇的催化氧化反应,反应方程式为![]() ,属于氧化反应;④为乙醇和乙酸的酯化反应,反应方程式为
,属于氧化反应;④为乙醇和乙酸的酯化反应,反应方程式为![]() ,属于酯化反应或取代反应;
,属于酯化反应或取代反应;
《2》(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸;
(3)液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.6g 12C中约含有3.01×1023个碳原子
B.1 mol任何物质都含有6.02×1023个分子
C.1 mol O2的质量是32 g·mol-1
D.64 g氧相当于2 mol氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活和健康,汽车尾气的大量排放是造成雾霾天气的重要原因之一。己知汽车尾气排放时容易发生以下反应:
①CO(g) +1/2 O2(g)![]() CO2(g) △H1=a kJ·mol-1
CO2(g) △H1=a kJ·mol-1
②2NO(g) +O2(g)![]() 2NO2(g) △H2=b kJ·mol-1
2NO2(g) △H2=b kJ·mol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=c kJ·mol-1
2NO(g) △H3=c kJ·mol-1
④2CO(g) +2NO(g)![]() N2(g)+2CO2(g) △H4
N2(g)+2CO2(g) △H4
请回答下列问题:
(1)写出反应①的平衡常数表达式K=___________________。
(2)下列情况能说明反应③已达平衡状态的是______________(填编号)。
A.在恒温恒容的容器中,混合气体的密度保持不变
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.在恒温恒压的容器中,NO的体积分数保持不变
D.单位时间内生成1mol NO2的同时消耗了lmol NO
(3)根据上述反应,确定反应④中△H4=__________kJ·mol-1
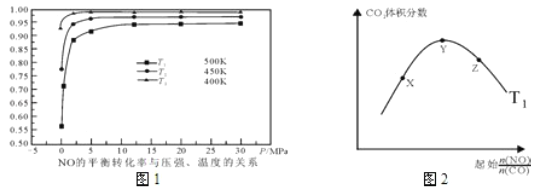
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。试分析实际化工生产中不采用高压的原因_________________________________________。
(5)其他条件不变时,探究反应④中平衡时CO2的体积分数与反应物中起始n(NO)/n(CO)的比值的关系,得到如图2所示的曲线。在X、Y、Z三点中,CO的转化率从大到小的顺序是________________。
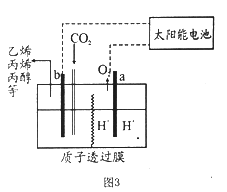
(6)据报道以二氧化碳为原料采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如图3所示。其中b极上生成乙烯的电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的检验中,其结论一定正确的是( )
A.某溶液为蓝色,则该溶液一定是CuSO4溶液
B.向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl-
C.向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+
D.加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+ = Cu2++H2↑
B.向CH3COOH溶液中加入CaCO3:2 CH3COOH+CaCO3 = 2 CH3COO-+Ca2++H2O+CO2↑
C.稀硫酸与Ba(OH)2溶液混合:H++ SO![]() +OH-+ Ba2+ = BaSO4↓+H2O
+OH-+ Ba2+ = BaSO4↓+H2O
D.NaOH溶液与KHCO3溶液混合:OH- + HCO3- = H2O +CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,下列叙述正确的是( )
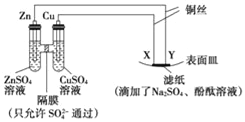
A. X为正极,发生氧化反应 B. Y与滤纸接触处有氧气生成
C. X为阳极,发生氧化反应 D. X与滤纸接触处变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中括号内的物质是杂质,试将除杂试剂填入表中:
(1) | (2) | (3) | (4) | (5) | |
混合物 | CO (CO2) | Fe2O3 (Al2O3) | SiO2 (NaCl) | FeSO4 (CuSO4) | NaHCO3 (Na2SiO3) |
除杂试剂 | _____ | _____ | _____ | _____ | _____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com