
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
分析 (1)加入足量的氧化剂X,目的是氧化氯化亚铁为氯化铁,加入的氧化剂不能引入新的杂质;
(2)FeCl3溶液中铁离子水解生成氢氧化铁和氯化氢,蒸发过程中会促进水解得到氢氧化铁,需要在酸溶液中抑制其水解得到晶体;
(3)FeCl3•6H2O晶体不溶于乙醇,水和乙醇混溶;
(4)①配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶;
②A、润洗滴定管的基本操作要求,从滴定管上口加少量所需的酸或碱液,使滴定管内壁充分润洗;
B、移液管取草酸溶液时,不能将尖嘴处的液体吹入锥形瓶,否则使实验误差偏高;
C、根据滴定管规范操作要求判断;
D、滴定中的误差分析,可以归结为标准溶液消耗体积的多少频道测定结果.
解答 解:(1)实验步骤中氯化亚铁溶液中加入足量的氧化剂X应是氧化氯化亚铁生成氯化铁,不能引入新的杂质,
A.KMnO4(H+) 会引入钾离子、锰离子杂质,故A错误;
B.稀硝酸能氧化氯化亚铁,但引入硝酸根离子,故B错误;
C.H2O2 在酸性溶液中氧化氯化亚铁为氯化铁,过氧化氢被还原为水,故C正确;
D.通入Cl2 发生反应2FeCl2+Cl2=2FeCl3,不引入新的杂质,故D正确;
故答案为:CD;
(2)FeCl3溶液中铁离子水解生成氢氧化铁和氯化氢,蒸发过程中会促进水解得到氢氧化铁,需要在酸溶液中抑制其水解得到晶体,从FeCl3溶液制得FeCl3•6H2O晶体的操作步骤是:加入盐酸后蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到晶体,
故答案为:盐酸;蒸发浓缩、冷却结晶;
(3)过滤后用少量乙醇洗涤FeCl3•6H2O晶体,选用乙醇的原因是:洗去晶体表面的水,减少氯化铁晶体的溶解损耗,
故答案为:洗去晶体表面的水,减少氯化铁晶体的溶解损耗;
(4)①因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,称取m g无水FeCl3样品,溶于稀盐酸,配制成100mL溶液需要100mL容量瓶,
故答案为:100mL容量瓶;
②A、润洗滴定管时,应从滴定管上口加少量所需的酸或碱液,使滴定管内壁充分润洗,并不需要加满,故A不正确;
B、若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,消耗标准溶液体积减小,则会使样品中FeCl3的质量分数的测量结果偏低,故B不正确;
C、滴定时,左手轻轻向内扣住活塞,手心空握以免碰到活塞使其松动漏出溶液,故C正确;
D、滴定终点读取滴定管刻度时,仰视标准液液面,由于读数自上而下逐渐增大,所以读数偏大,会使实验误差偏高,故D正确;
故答案为:CD;
③发生反应2Fe3++2I-=I2+2Fe2+,滴入几滴淀粉溶液会变蓝色,用cmol•L-1Na2S2O3溶液滴定,发生反应I2+2S2O32-═2I-+S4O62-,溶液蓝色褪去,滴定终点的现象是溶液由蓝色变无色,且半分钟内不变色,
称取m g无水FeCl3样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用cmol•L-1Na2S2O3溶液滴定,消耗VmL,2Fe3++2I-=I2+2Fe2+,I2+2S2O32-═2I-+S4O62-,
2Fe3+~I2~2S2O32-,
2 2
n cmol•L-1 ×V×10-3L
n=0.001cVmol,
称取m g无水FeCl3样品,溶于稀盐酸,配制成100mL溶液中含氯化铁物质的量=0.001cVmol×$\frac{100ml}{10ml}$=0.01cVmol,
样品中FeCl3的质量分数=$\frac{0.01cVmol×162.5g/mol}{mg}$×100%=$\frac{162.5cV}{m}%$,
故答案为:溶液由蓝色变无色,且半分钟内不变色;$\frac{162.5cV}{m}%$.
点评 本题考查了物质制备的实验过程分析、溶液配制、滴定实验的注意问题和计算判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
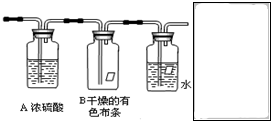 某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
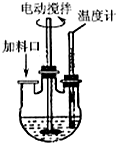 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
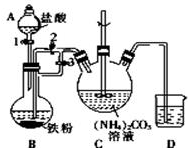 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.
乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度平衡正向移动 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单体的质量之和就是所生成高聚物的质量 | |
| B. | 氨基酸能发生的反应有:酯化反应、水解反应、成肽反应、与酸或碱的中和反应 | |
| C. | 天然蛋白质的水解产物为α-氨基酸,遇饱和硫酸铵或硫酸钠溶液会发生变性 | |
| D. | 淀粉和纤维素因聚合度不同所以他们不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
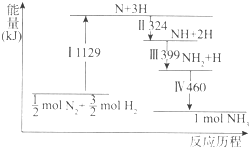
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | ||
| C. | Ⅳ中NH2与H2生成NH3 | D. | N2(g)+3H2(g)?2NH3(g)是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com