
分析 (1)铝离子、氢离子抑制铵根离子水解,且铝离子抑制程度小于氢离子;
(2)①NH4Al(SO4)2为强酸弱碱盐,其溶液呈酸性,升高温度促进水解;
②根据电荷守恒计算;
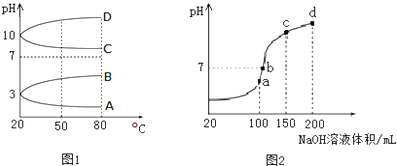
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性.
解答 解:(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,
故答案为:小于;
(2)①NH4Al(SO4)2为强酸弱碱盐,其溶液呈酸性,升高温度促进水解,导致溶液酸性增强,溶液的pH减小,
故选A;
②根据电荷守恒得2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol•L-1-10-11mol•L-1=10-3-10-11mol•L-1,
故答案为:10-3-10-11;
(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,a点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了离子浓度大小比较、盐类水解等知识点,离子浓度大小比较常常与盐类水解、弱电解质的电离联合考查,确定离子浓度大小时要结合电荷守恒、物料守恒来分析解答,难点是(3)题,知道图象中各个点的溶质即可解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油主要是由烃组成的混合物 | B. | ①主要发生物理变化 | ||
| C. | ②包括裂化,裂解等过程 | D. | ③中产物名称是二溴已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D
(1)在一定条件下,对于密闭容器中进行的可逆反应:2HI (g)?H2(g)+I2(g),下列说法中,能说明这一反应已经达到化学反应限度的是D查看答案和解析>>
科目:高中化学 来源: 题型:解答题
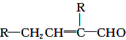 水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下:
水杨酸酯E为紫外线吸收剂,可用于配制防晒霜.E的一种合成路线如下: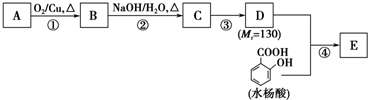
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色变深可能是Fe2+或I-被氧化 | |
| B. | 原溶液中肯定含有Fe2+、Cl-、NO3-,肯定不含有Na+、Fe3+、I-、CO32- | |
| C. | 取少量原溶液,加入盐酸酸化的BaCl2溶液,若有白色沉淀产生,则原溶液中含有Mg2+ | |
| D. | 该溶液中是否存在Na+,无需通过焰色反应确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )中的官能团名称为羧基.
)中的官能团名称为羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
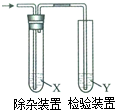 某同学在实验室完成以下实验:
某同学在实验室完成以下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com