
 Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3.下面是他的制备实验过程:用50mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氢氧化铜与稀盐酸反应:Cu(OH)2+2H+=Cu2++2H2O |
| B、硫酸铜与氢氧化钡反应:Cu2++2OH-=Cu(OH)2↓ |
| C、氧化铜与稀硫酸反应:CuO+4H++SO42-=Cu2++SO2↑+2H2O |
| D、铜与浓硝酸反应:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
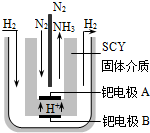 现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高.查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
| a |
| b |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com