
| △c |
| △t |
| n |
| V |
| 消耗量 |
| 起始量 |
| 平衡混合气体中C的物质的量 |
| 平衡混合气体物质的量总和 |
| 0.5xmol/L |
| 2min |
| 1mol/L |
| 5mol/L |
| 0.5×2 |
| 4+1.5+0.5×2+0.5 |


科目:高中化学 来源: 题型:
| A、在100℃、101kPa条件下,液态水的气化热为40.69kJ?mol-1,则H2O(g)?H2O(l)的△H=40.69kJ?mol-1 |
| B、在PH=2的盐酸中,水电离出来的c(OH-)=1.0×10-12mol?L-1 |
| C、CO(g)的燃烧热是283.0kJ?mol-1,则2CO2(g)═2CO(g)+O2(g)的△H=2×(-283.0)kJ?mol-1 |
| D、常温下,在0.10mol?L-1的NH3?H2O溶液中加入少量NH4Cl晶体,能使NH3?H2O的电离度降低,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
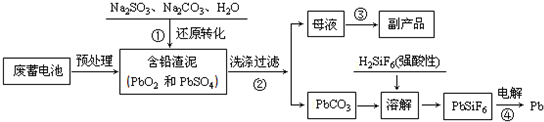

| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
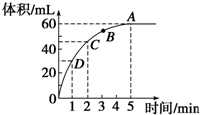 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g?mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为1.1g?mL-1),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体.请回答下列问题(涉及物质均用化学式表示).| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com