
| A. | 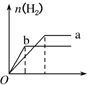 | B. | 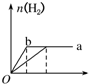 | C. | 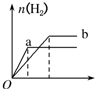 | D. | 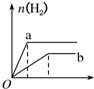 |
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
19世纪初,某科学家提出原子学说,他认为物质有原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是
A. 汤姆生 B. 道尔顿 C. 卢瑟福 D. 玻尔
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 63.8g | B. | 53.6g | C. | 46.8g | D. | 43.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | L、M的单质与稀硫酸反应速率:M>L | |
| C. | T、Q的氢化物常态下均为无色气体 | |
| D. | L、Q形成的简单离子核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+:1s22s22p6 | B. | F:1s22s22p5 | ||
| C. | Cl-:1s22s22p63s23p5 | D. | Mn:1s22s22p63s23p63d54s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO、H2、SO2 | B. | SO2、H2S、O2 | C. | HCl、CO2、H2S | D. | H2、SO2 、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2 (mol) | H2 (mol) | CH3OH (mol) | H2O (mol) |
| 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | |||
| 20min | 1 | |||
| 30min | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com