
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g;再通过足量石灰水,石灰水增重17.6g。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
I.现以A为主要原料合成某种具有水果香味的有机物,其合成路线如图所示。

(1)A分子中官能团的名称是______,E的结构简式为________。
(2)写出以下反应的化学方程式,并标明反应类型。反应③的化学方程式是__________; G是生活中常见的高分子材料,合成G的化学方程式是________________________;
Ⅱ.某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。

(1)实验开始时,试管甲中的导管不伸入液面下的原因是_______________;当观察到试管甲中________ 现象时认为反应基本完成。
(2)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。

试剂b是____________;分离方法①是__________;分离方法③是________。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
【答案】碳碳双键 CH3COOCH2CH3 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 nCH2=CH2
2CH3CHO+2H2O 氧化反应 nCH2=CH2![]()
![]() 乙酸乙酯中混有的乙酸和乙醇蒸汽易溶于水防倒吸 导气管中不再有油状液体往下滴 稀硫酸 分液 蒸馏 除去乙酸乙酯中的水分
乙酸乙酯中混有的乙酸和乙醇蒸汽易溶于水防倒吸 导气管中不再有油状液体往下滴 稀硫酸 分液 蒸馏 除去乙酸乙酯中的水分
【解析】
I.①取一定量的该烃,使其完全燃烧后的气体通过装有足量无水氯化钙的干燥管,干燥管增重7.2g,即产生水的质量是7.2g,水的物质的量是0.4mol;再通过足量石灰水,石灰水增重17.6g,即产生二氧化碳的质量是17.6g,物质的量是0.4mol,所以该烃的最简式是CH2。②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1,所以相对分子质量是1.25×22.4=28,则A是乙烯。乙烯和水发生加成反应生成B是乙醇,乙醇催化氧化生成C是乙醛,乙醇被酸性高锰酸钾溶液氧化生成D是乙酸,乙醇和乙酸发生酯化反应生成E是乙酸乙酯。乙烯和氯化氢发生加成反应生成F是氯乙烷。
(1)A乙烯分子中官能团的名称是碳碳双键。E是乙酸乙酯,结构简式为CH3COOCH2CH3。
(2)反应③是乙醇的催化氧化,反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O;G是生活中常见的高分子材料,说明该反应是乙烯的加聚反应,则合成G的化学方程式是nCH2=CH2
2CH3CHO+2H2O;G是生活中常见的高分子材料,说明该反应是乙烯的加聚反应,则合成G的化学方程式是nCH2=CH2![]()
![]() ;
;
Ⅱ.(1)由于生成的乙酸乙酯中混有的乙酸和乙醇蒸汽易溶于饱和碳酸钠溶液,为了防倒吸,因此实验开始时,试管甲中的导管不伸入液面下;由于乙酸乙酯不溶于水,因此当观察到试管甲中导气管中不再有油状液体往下滴现象时认为反应基本完成。
(2)乙酸乙酯中含有乙酸和乙醇,加入饱和碳酸钠溶液分液得到A和B,根据流程图可知A主要是乙酸乙酯,由于其中还含有少量水,则加入无水碳酸钠可以除去除去乙酸乙酯中的水分;B中含有醋酸钠、碳酸钠和乙醇,蒸馏得到乙醇(E),C中含有醋酸钠,加入稀硫酸得到乙酸,然后再蒸馏得到乙酸。
根据以上分析可知试剂b是稀硫酸;分离方法①是分液;分离方法③是蒸馏。
(3)在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中的水分。


科目:高中化学 来源: 题型:
【题目】常温下,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图。已知0.10molL-1氨水的电离度为1.32%,下列叙述错误的是( )
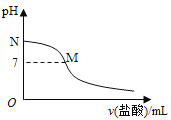
A. 该滴定过程应该选择甲基橙作为指示剂 B. M点对应的盐酸体积小于20.0mL
C. M点处的溶液中c(H+)=c(OH-) D. N点处的溶液中pH>12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列说法中正确的是
A.酿酒过程中,葡萄糖可通过水解反应生成酒精
B.利用催化转化装置可以将汽车尾气中的NO和CO转化为无害气体
C.酸性高锰酸钾溶液中加入植物油充分振荡后,溶液紫色不会褪去
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )

A. X的化学式为C10H10O6
B. X分子中含有官能团为羟基、羧基和酯基
C. X在一定条件下只能和酸发生酯化反应,不能和醇发生酯化反应
D. 1 mol X分别与足量的Na、NaHCO3溶液反应,消耗这两种物质的物质的量分别为3 mol、1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)固态 CO2(干冰)所属晶体类型___________,所含化学键类型为__________(填“非极性键”或“极性键”或“离子键,下同)。CO2与Na2O2反应过程形成化学键类型为______________________________。
(2)中科院的科研人员在Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

①Na-Fe3O4和HMCM-22 在反应中的作用为_______________。
②写出(X)的所有同分异构体结构简式_______________。
③关于X与Y的说法正确的是__________(填序号〕。
a.最简式相同 b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色 d.X与Y互称同系物
(3)同温同压下,蒸气密度是氢气15倍的烷烃(M),写出其与氯气反应生成一氯代烃的方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H > 0)
2NO2 △H > 0)
(a)将两容器置于沸水中加热
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )

A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于消去反应的是 ( )
A.溴乙烷和氢氧化钠溶液混合加热
B.一氯甲烷与苛性钠的乙醇溶液混合共热
C.氯苯与氢氧化钠溶液混合加热
D.1—碘丁烷与氢氧化钾的乙醇溶液混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g)![]() C(g)
C(g)
(1)若开始时放入1mol A和1mol B,到达平衡后,生成amol C。这时A的物质的量为_____mol。
(2)若开始时放入3mol A和3mol B,到达平衡后,生成C的物质的量为____mol。
(3)若开始时放入xmol A、2mol B和1mol C,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=___mol,y=___mol。平衡时,B的物质的量________(选填一个编号)。
(甲)大于2mol (乙)等于2mol (丙)小于2mol (丁)可能大于、等于或小于2mol
II. 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(4)开始时放入1mol A和1mol B到达平衡后生成bmol C,将b与(1)小题的a进行比较,则________(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
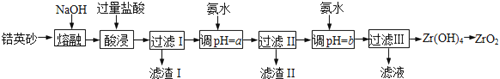
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com