
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
【答案】 关闭K1、K2,向分液漏斗中注入水,打开分液漏斗活塞,开始有少量水滴下,一段时间后,水不能滴下,说明装置A气密性良好 2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O 稀释ClO2,使生成的ClO2全部进入三颈瓶中 d 2ClO2+2OH-+H2O2=2 ClO2-+2H2O+O2 防止NaClO2分解 在38℃-60℃下,减压蒸发结晶过滤、洗涤、干燥 43.5a
【解析】试题分析:(1)根据压强原理,通过关闭K1、K2,向分液漏斗中注入水的方法检验装置A的气密性;根据得失电子守恒配平NaClO3、Na2SO3、H2SO4生成ClO2的方程式;(2)根据纯空气中ClO2的体积分数在10%以下比较安全分析;(3)根据亚氯酸钠(NaClO2)是漂白剂分析;(4)B装置中 ClO2、NaOH、H2O2反应生成NaClO2、O2;高于60℃时NaClO2分解成NaClO3和NaCl;NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2,要得到NaClO2需要控制温度蒸发结晶。(5)NaClO2在一定条件下可以将CN-氧化成二氧化碳和氮气,根据电子守恒,NaClO2与CN-的关系式是![]() ;
;
解析:(1). 关闭K1、K2,向分液漏斗中注入水,打开分液漏斗活塞,开始有少量水滴下,一段时间后,水不能滴下,说明装置A气密性良好;根据得失电子守恒,NaClO3、Na2SO3、H2SO4生成ClO2的方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;(3). 实验过程中需要持续通入空气的目的是稀释ClO2,使生成的ClO2全部进入三颈瓶中;(3亚氯酸钠(NaClO2)是漂白剂,能使石蕊、酚酞、pH试纸褪色,所以检测三颈瓶中溶液酸碱性用PH计,选d。(4) B装置中ClO2、NaOH、H2O2反应生成NaClO2、O2的离子方程式是2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;高于60℃时NaClO2分解成NaClO3和NaCl,所以装置B使用冰水浴;NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2,要得到NaClO2需要在38℃-60℃下,减压蒸发结晶过滤、洗涤、干燥;(5)设理论上至少需要NaClO2的质量是xg;
![]()
452.5g 104g
Xg a![]() g·L-1
g·L-1![]()
![]()
X= 43.5a。


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A. BF3为三角锥形分子
B. NH的电子式为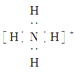 ,离子呈平面正方形结构
,离子呈平面正方形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的2p轨道形成的s—p σ键
D. CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成C—H σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯各盛有100 mL 3 mol·L-1的盐酸和氢氧化钠溶液,向烧杯分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲∶乙=3∶4,则加入铝粉的质量为
A. 1.8 g B. 2.7 g C. 3.6 g D. 5.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。(ClO2中氯元素的化合价为+4价)
(1)浓盐酸在反应中表现出来的性质是____________(填写编号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)当产生0.1 mol Cl2时,转移电子的数目为_____________;
(3)ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以同质量的物质得到的电子数多少来衡量)是Cl2的______倍(结果小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原4.64 g某金属氧化物,把生成的二氧化碳全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此金属氧化物是下列中的( )
A. 氧化铜 B. 氧化铁 C. 四氧化三铁 D. 二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)一空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5.用该电池为电源,选用情性电极电解硫酸铜溶液,实验装置如图所示。下列说法正确的是

A. VB2电极的电极反应式为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中SO42-向b电极移动
D. 电解过程中,b电极表面有红色物质析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是正盐,B是能使品红溶液退色的气体,G是红棕色气体。按要求回答问题:
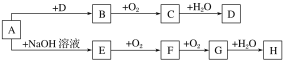
(1)写出下列物质的化学式:A____________,B____________。
(2)写出下列反应的化学方程式:
E→F___________________G→H__________________;D的溶液与木炭反应的化学方程式: ________________。
(3)检验某溶液中是否含D中阴离子的方法是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com