
【题目】Ⅰ.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
(1)写出放电时负极的电极反应式:___;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
Ⅱ.人们习惯上把电解饱和食盐水的工业叫做氯碱工业。如下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液。请回答以下问题:
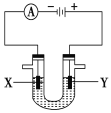
(4)X极上的电极反应式是:__________。
(5)检验Y电极反应产物的方法是_______。
(6)电解饱和NaCl溶液的离子方程式是:___________。
【答案】Pb -2e- + SO42- = PbSO4 增大 0.5mol Pb 2H++2e-=H2↑ 将湿润的淀粉KI试纸放在气体出口,若观察到试纸变蓝,证明有Cl2产生 2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
【解析】
(1)铅蓄电池中,负极是铅,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应;
(2)根据放电时总反应Pb+PbO2+2H2SO4═2PbSO4+2H2O进行计算回答;
(3)铅蓄电池充电时,电池正极和电源正极相连,电池负极和电源的负极相连,充电时的反应和放电时的反应互为逆过程;
(4)X电极上氢离子放电生成氢气;
(5)Y电极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验;
(6)电解食盐水生成氢氧化钠、氯气和氢气。
(1)铅蓄电池中,负极是铅,负极上铅失电子发生氧化反应:Pb-2e-+SO42-=PbSO4;
(2)放电时总反应为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,反应转移2mol电子,消耗硫酸2mol,硫酸被消耗,所以溶液的酸性减弱,pH将增大,当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为0.5mol;
(3)放电完后,对该电池进行充电,在连接电源的负极一端是阴极,发生反应:PbSO4+2e-=Pb+SO42-,在连接电源的负极一端生成Pb;
(4)电极上氢离子放电生成氢气,电极反应为2H++2e-=H2↑;
(5)Y电极上氯离子放电生成氯气,电极反应为2Cl--2e-=Cl2↑,氯气可以用湿润的淀粉碘化钾试纸检验,如果湿润的淀粉碘化钾试纸变蓝色,则证明有氯气生成,
(6)电解食盐水生成氢氧化钠、氯气和氢气,电解池反应式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
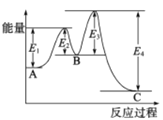
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法不正确的是( )
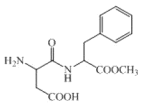
A.能使FeCl3溶液显紫色
B.该有机物不存在顺反异构
C.能发生取代反应和加成反应
D.1mol该有机物完全水解最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
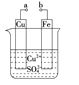
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D.a和b连接时,铜片上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
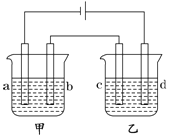
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是

A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据氧化还原反应CuSO4+Zn=ZnSO4+Cu,可设计如下原电池装置:

⑴该原电池电解质溶液中的溶质是_______。
⑵电极A可选用:____,该电极的反应现象是:_____。
⑶电极B只能用:____,该电极的反应现象是:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究甲醛与新制的Cu(OH)2的反应:
(1)向6 mL 6 mol·L1 NaOH溶液中滴加8滴2%CuSO4溶液,振荡,加入0.5 mL15%甲醛溶液,混合均匀,水浴加热,迅速产生红色沉淀,其周围剧烈产生无色气体。
(2)反应停止后分离出沉淀,将所得沉淀洗净后加入浓盐酸,不溶解。
(3)相同条件下,甲酸钠溶液与新制的Cu(OH)2反应,未观察到明显现象。
已知:Cu2O![]() [CuCl2],甲醛是具有强还原性的气体。
[CuCl2],甲醛是具有强还原性的气体。
下列说法正确的是
A.红色沉淀的主要成分不是Cu2O,可能是Cu
B.将产生的无色气体通过灼热的CuO后得到红色固体,气体中一定含有CO
C.从甲醛的结构 ![]() 推测,其氧化产物可能为碳酸(
推测,其氧化产物可能为碳酸(![]() ),因此实验中得到的无色气体是CO2
),因此实验中得到的无色气体是CO2
D.含有-CHO的有机物都可以被新制Cu(OH)2氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com