
分析 (1)安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,反应方程式为:3NaN3=Na3N+4N2↑,一变二为分解反应;
(2)根据n=$\frac{m}{M}$计算求解;
(3)根据3NaN3=Na3N+4N2↑,3molNaN3发生反应生成4mol的气体,体积为:4mol×22.4L/mol=89.6L;
(4)根据n=$\frac{m}{M}$计算KOH的物质的量,根据每200个水分子中有1个K+计算水的物质的量,再根据m=nM计算水的质量;
(5)镁在CO2 中燃烧生成氧化镁和单质碳,化学方程式2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
解答 解:(1)安全气囊内的NaN3发生化学反应生成氯化钠(Na3N)与氮气,反应方程式为:3NaN3=Na3N+4N2↑,一变二为分解反应,
故答案为:3NaN3=Na3N+4N2↑;分解反应;
(2)n=$\frac{m}{M}$=$\frac{195g}{65g/mol}$=3mol,故答案为:3mol;
(3)根据3NaN3=Na3N+4N2↑,3molNaN3发生反应生成4mol的气体,体积为:4mol×22.4L/mol=89.6L,故答案为:89.6L;
(4)28g KOH的物质的量为$\frac{28g}{56g/mol}$=0.5mol,每200个水分子中有1个K+,则水的物质的量为0.5mol×200=100mol,则水的质量为100mol×18g/mol=1800g,
故答案为:1800;
(5)镁在CO2 中燃烧生成氧化镁和单质碳,化学方程式2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查物质的性质及化学反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液-定含有Fe2+、Cl-、NO3- | B. | 该溶液一定不含Na+、NH4+、SO42- | ||
| C. | 该无色气体对环境无污染 | D. | 该溶液可能含有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ③④⑤ | C. | ①②⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中NaClO是氧化剂 | |
| C. | Na2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒 | |
| D. | 若有2molFeCl3发生反应,转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气可做制冷剂 | |
| B. | 氧化铝可做耐火材料 | |
| C. | 晶体硅可用于制造光导纤维 | |
| D. | 过氧化钠可用于呼吸面具,提供氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO2与足量的 Na2O2反应时,转移的电子数为 NA 个 | |
| B. | 0.1mol 铁在 0.1molCl2 中充分燃烧,转移的电子数为 0.2NA 个 | |
| C. | 对于反应:A(g)+B(g)?C(g)+D(g)单位时间内生成 NA 个 A 分子时,同时消耗NA 个 C 分子,说明该反应一定达到最大限度 | |
| D. | Zn-H2SO4-Cu 原电池中,当电路中有 NA 个电子通过时,溶液的质量增加 1g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
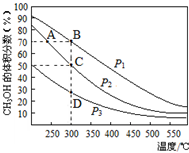 利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )
利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)═CH3OH(g).在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法正确的是( )| A. | 该反应的△H<0,且p1<p2 | |
| B. | 反应速率:ν逆(状态A)>ν逆(状态B) | |
| C. | 在C点时,CO转化率为75% | |
| D. | 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com