
【题目】将Fe2O3、Al2O3两种固体混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:
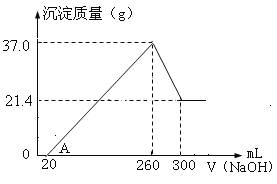
(1)原混合物中Fe2O3的质量是____________g。
(2)所用NaOH溶液物质的量浓度为___________。
(3)稀硫酸物质的量浓度为______________。
【答案】165 mol/L6.5 mol/L
【解析】
(1)由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明硫酸溶解氧化铝、氧化铁后硫酸有剩余,此时发生的反应为H2SO4+2NaOH=Na2SO4+2H2O,即最初加入的20mLNaOH溶液的作用是中和剩余的硫酸。从20mL~260mL氢氧化钠沉淀铁离子和铝离子,从260mL~300mL,NaOH溶解氢氧化铝,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,这说明最终得到的21.4g沉淀是氢氧化铁的质量,氢氧化铁的物质的量是21.4g÷107g/mol=0.2mol,根据铁元素守恒可知氧化铁的物质的量是0.1mol,质量是0.1mol×160g/mol=16g;
(2)从260mL~300mL,NaOH溶解氢氧化铝,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,氢氧化铝的质量是37g-21.4g=15.6g,物质的量是15.6g÷78g/mol=0.2mol,消耗NaOH为0.2mol,所以氢氧化钠的浓度为0.2mol÷0.04L=5mol/L;
(3)当V(NaOH溶液)=260mL时,沉淀量最大,此时为Fe(OH)3和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒2n(Na2SO4)=n(NaOH),故n(Na2SO4)=0.5×0.26L×5mol/L=0.65mol,根据硫酸根守恒n(H2SO4)=n(Na2SO4)=0.65mol,则c(H2SO4)=0.65mol÷0.1L=6.5mol/L。


科目:高中化学 来源: 题型:
【题目】4molL﹣1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
A.4 molL﹣1
B.0.2molL﹣1
C.2 molL﹣1
D.0.4 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 提取镁的过程涉及化合、分解、置换反应
D. 第④步电解时,还会产生副产品氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下几种可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集该雾霾,并经必要的预处理后得试样溶液,设计并完成了如下的实验。请根据以下的实验操作与现象,判断该同学得出的结论不正确的是
已知:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-

A. 试样中一定存在NH4+、Mg2+、SO42-和NO3-
B. 气体1和气体2成分一定相同
C. 试样中可能含有Al3+
D. 该雾霾中可能存在NH4NO3、NaCl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
A.NaCl、Cl2
B.NaHCO3、蔗糖
C.Ba(OH)2、HCl
D.H2SO4、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及氮的化合物在生产生活中有着重要的用途。
Ⅰ.某化学兴趣小组利用以下装置模拟合成氨并制备少量氨水
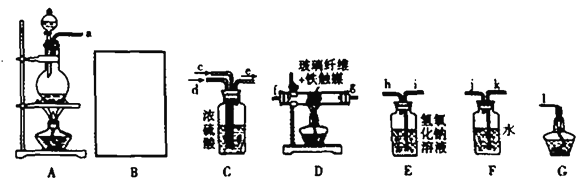
已知:加热(85℃) NH4Cl和NaNO2饱和溶液可以制取N2.
(1)用B仪器制取氢气(所用的药品是锌粒和稀盐酸)要做到“随开随用,随关随停”。可以选取下列______装置。
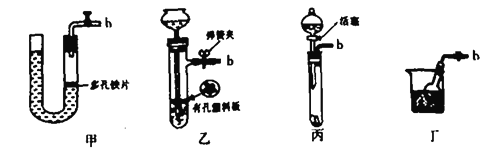
为了完成实验,装置从左到右接口的连接顺序是(装置不可重复使用):_______________
![]()
(2)D中玻璃纤维的作用是:__________。
(3)小组中甲同学认为F装置不太合理,实验中会产生倒吸。乙同学认真分析后认为该装置无需改进,他的理由是:___________。
Ⅱ.在通常情况下存在2NO2(g)![]() N2O4(g)的反应。恒温下,将一定量NO2和N2O4(g)的混合气体充入容积固定的2L密闭容器中,其中各气体物质的量浓度随时间变化关系如图所示。
N2O4(g)的反应。恒温下,将一定量NO2和N2O4(g)的混合气体充入容积固定的2L密闭容器中,其中各气体物质的量浓度随时间变化关系如图所示。
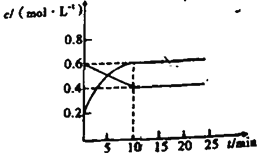
(4)反应2NO2(g)![]() N2O4(g)的熵变 ΔS____0,焓变ΔH_____0(填“>”、“<“”或“=”)。
N2O4(g)的熵变 ΔS____0,焓变ΔH_____0(填“>”、“<“”或“=”)。
(5)可作为判断上述可逆反应达到平衡状态的依据的是______
A.2v(N2O4)=v(NO2)
B.容器中压强不变
C.容器中气体的密度不变
D.容器中NO2的体积分数不变
E.容器内气体的颜色不变
(6)前10min内,用v(NO2)表示的反应速率为____mol·L-1·min-1.
(7)该条件下达到平衡状态时容器中气体压强是起始时压强的____倍.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱。
(1)“550℃焙烧”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________。
(4)“净化除杂1”过程中,先在40℃-50℃加入H2O2,其作用是_______(离子方程式表示):再升温至80-85℃,加入Na2CO3溶液,调pH至4.5以达到净化除杂的目的。
(5)为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判断NH4HC2O4溶液呈________(填“酸性”、“碱性”或“中性”)。
②将草酸钴溶液用过量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液20.00mL,则草酸钴样品的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用乙炔燃烧产生的高温火焰来切割金属。若用R表示乙炔,其燃烧的化学方程式为:2R+3O2=4CO2+2H2O,则乙炔的化学式是( )
A.C2H4B.C2H2C.CH3COOHD.C2H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com