
周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z基态原子的最外能层只有一个电子,其他能层均己充满电子。请回答下列问题:
(1) Z2+基态核外电子排布式为______________。
(2) YX4-的空间构型是______________,与YX4-互为等电子体的一种分子为_____________(填化学式);HYX4酸性比HYX2强,其原因是_____________。
(3)结构简式为RX (W2H3)2的化合物中R原子的杂化轨道类型为_____________;lmo1RX (W2H3) 2分子中含有σ键数目为_____________。
(4)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是_____________。
A. [Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+给出孤对电子,NH3提供空轨道
C.在[Z(WH3)4]SO4组成元素中第一电离能最大的是氧元素
(5)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
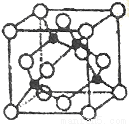
①该晶体的化学式为_____________
②已知Z和Y的电负性分别为1.9和3.0,则Y与L形成的化合物属于_____________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,则该晶体中Z原子和Y原子之间的最短距离为_____________pm(只写计算式)。
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高一下期中化学试卷(解析版) 题型:填空题
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:

Ⅰ.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z可组成的化合物的化学式为 。
(3)写出铜和X的最高价氧化物水化物浓溶液反应的离子方程式 。
Ⅱ.若Y和Z的核外电子数之和为22
(1)工业上生产Y氢化物的化学方程式为 。
(2)将X的最高价氧化物通人到硅酸钠溶液中,实验现象是 。
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4 mol时,产生气体的体积(标准状况下)是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽黄山屯溪一中高二下期中理科化学试卷(解析版) 题型:选择题
分子式为C9H10O2的含有一价苯环的所有酯类同分异构体有
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度 /mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温 下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0(填“﹥”、“=”或“﹤”);焓变△S______0(填“﹥”、“=”或“﹤”)。
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
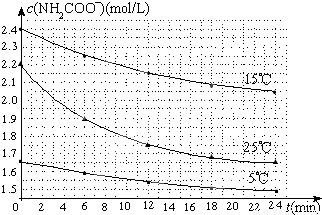
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮训练三化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如右图所示。下列判断正确的是
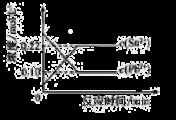
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H﹥0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高中高三第四次模拟理综化学试卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1 mol/LNa2CO3溶液中:c(Na+)=(HCO3-)+c(H2CO3)+2c(CO32-)
B.pH=l2的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等
C.将0.2mol/LNaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三第四次模拟理综化学试卷(解析版) 题型:填空题
双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为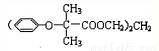 。已知:
。已知:
Ⅰ.
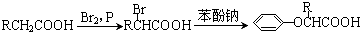
Ⅱ.
双安妥明的合成路线如下:

已知:C的分子式为C4H8,且支链有一个甲基;Ⅰ能发生银镜反应且1mol I能与2mol氢气发生加成反应;K的结构具有对称性.试回答下列问题:
①写出结构简式:A_________,J _________,C化学名称_________。
②反应(2)的条件是_________,反应(3)的类型是_________。
③写出反应(4)的化学方程式_________。
④与F互为同分异构体,且属于酯类的有机物,写出其中能发生银镜反应的有机物的结构简式_________、_________。
⑤与丙烯酸互为同系物,且相对分子质量为100,其结构共有_________种(不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期中化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,回答相关的问题
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ | ⑾ |
(1)写出④的元素符号;
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式______________。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是______________ (填相应化学式,下同),碱性最强的是______________。
(4)这些元素中(除⑨外),原子半径最小的是______________ (填元素符号,下同),原子半径最大的是______________。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为______________ (方程式中用具体元素符号表示)。
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:选择题
下列化学用语中,正确的是
A.氯化钠的电子式为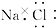
B.镁的原子结构示意图为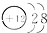
C.氯化氢分子的形成过程可用电子式表示式: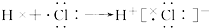
D.重水的化学式为 21H2O(或D2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com