
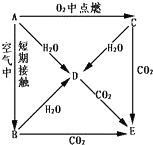
 A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质.分析 A、B、C、D、E五种物质都含钠元素,已知A 为单质,则A为Na,A在氧气中燃烧生成C为Na2O2,A在空气中短期接触生成B为Na2O,A、B、C都能和水反应生成D,则D为NaOH,可知E是Na2CO3,据此解答.
解答 解:A、B、C、D、E五种物质都含钠元素,已知A 为单质,则A为Na,A在氧气中燃烧生成C为Na2O2,A在空气中短期接触生成B为Na2O,A、B、C都能和水反应生成D,则D为NaOH,可知E是Na2CO3.
(1)该五种物质中用于焙制糕点的发酵粉及治疗胃酸过多的药品是NaHCO3,故答案为:NaHCO3;
(2)将CO2通入Na2CO3的饱和溶液中有白色沉淀生成,该反应的离子方程式为:CO2+H2O+2Na++CO32-=2NaHCO3↓,
故答案为:CO2+H2O+2Na++CO32-=2NaHCO3↓;
(3)写出A→D、C→D、C→E反应的化学方程式
A→D的反应方程式为:2Na+H2O=2NaOH+H2↑,
C→D的反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
C→E的反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na+H2O=2NaOH+H2↑;2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查无机物推断,涉及Na元素单质及其化合物之间的相互转化关系,判断A为Na,再根据转化关系推断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1molNa2O2固体跟足量CO2气体完全反应,转移NA个电子 | |
| C. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| D. | 100mL 0.1mol/L盐酸中含HCl分子数为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
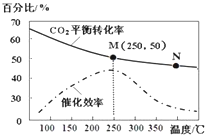
| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 化学平衡常数:KN>KM | |
| C. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 减少二氧化碳的排放以及资源化利用具有重要意义.
减少二氧化碳的排放以及资源化利用具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
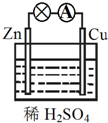
| A. | Zn为正极,Cu为负极 | B. | 该装置将化学能转变为电能 | ||
| C. | 正极反应式为Cu-2e-═Cu2+ | D. | 电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 | |
| D. | 电池正极反应式为:2MnO2+2e一+2H2O═2MnO (OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
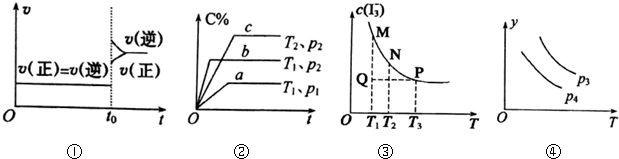
| A. | 图①对于达到平衡状态的N2(g)+3H2(g)?2NH3(g),在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 图②p2<p1,T1<T2 | |
| C. | 图③是反应:I2(aq)+I-(aq)?I3-(aq)的平衡体系中,I3-的物质的量浓度与温度(T)的关系图(曲线上的任何一点都代表平衡状态):Q点时,v正>v逆 | |
| D. | 图④对于反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Z的百分含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com