
����Ŀ������������Ϊ����Խ��Խ���ĵĻ������⣮�����к��ж�������������Ϳ�������������Ⱦ�����ʣ���ش��������⣺
��1��ij�о�С����NaOH��Һ����β���еĶ��������õ���Na2SO3��Һ���е�⣬��������Ĥ��ϵ��װ����ͼ��ʾ���缫����Ϊʯī��
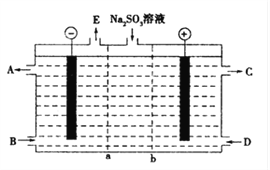
��a��ʾ____���ӽ���Ĥ�����������������A��E�ֱ���������е�ԭ�ϻ��Ʒ������CΪ���ᣬ��A��ʾ______��E��ʾ_______��
�������ĵ缫��ӦʽΪ___________________________________��
(2)Na2SO3��Һ����SO2�Ĺ����У�pH��n(SO32��):n(HSO3��)�仯��ϵ���±�:
n(SO3��):n(HSO3��) | 99��1 | 1��1 | 1��99 |
pH | 8.2 | 7.2 | 6.2 |
��Na2SO3��Һ��______�ԣ����ɣ��������ӷ���ʽ��ʾ��_______________________
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ): ____
a��c��Na����=2c��SO32-����c��HSO3������
b��c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH����
c��c��Na����+c��H����= c��SO32-��+ c��HSO3����+c��OH����
��3��SO2�����������������Ͻ��д���������ȡ���ᣬ����SO2�����������ķ�ӦΪ��2SO2��g��+O2��g��![]() 2SO3��g��������T1�桢0.1MPa�����£���һ�ܱ�����ͨ��SO2��O2������n��SO2����n��O2��=2��1���������������ѹǿ�뷴Ӧʱ����ͼ��ʾ��
2SO3��g��������T1�桢0.1MPa�����£���һ�ܱ�����ͨ��SO2��O2������n��SO2����n��O2��=2��1���������������ѹǿ�뷴Ӧʱ����ͼ��ʾ��
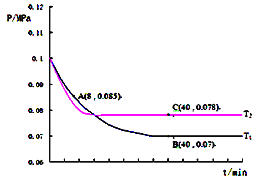
��ͼ��A��ʱ��SO2��ת����Ϊ________��
���������������������£����T2��ʱѹǿ�ı仯������ͼ��ʾ��C�������Ӧ����vc��������A����淴Ӧ����vA ���棩�Ĵ�С��ϵΪvc������_____vA ���棩�����������������=����
��ͼ��B���ѹǿƽ�ⳣ��kp=__________����ƽ���ѹ����ƽ��Ũ�ȼ��㣮��ѹ=��ѹ�����ʵ�����������
���𰸡� �� NaOH��Һ ���� SO32����2e��+H2O=2H++SO42�� ���� SO32-��H2O HSO3��+OH�� ab 45% �� 24300��MPa��-1
����������1�������������ͼ�����������Ϣ��֪���缫����Ϊʯī������Ĥ��ϵ��Na2SO3��Һʱ������Ϊ�����ң����������������ɣ��������Ϸ���SO32����2e��+H2O=2H++SO42������Һ��Ϊ���ԣ�����Ϊ����ʵ���ң������Ϸ���2H++2e��=H2����ˮ����������ӷŵ磬��Һ��Ϊ��������������Ҫ�����ƶ���SO32����Ҫ�������ƶ�������aΪ�����ӽ���Ĥ��bΪ�����ӽ���Ĥ����a��ʾ�����ӽ���Ĥ��A��E�ֱ���������е�ԭ�ϻ��Ʒ������CΪ���ᣬ��A��ʾNaOH��Һ��E��ʾ�������������ĵ缫��ӦʽΪSO32����2e��+H2O=2H++SO42����
(2)����������ɱ�����Ϣ��֪������Һ��SO3�������϶�ʱ����Һ�Լ��ԣ���HSO3�������϶�ʱ����Һ�����ԣ��ʵĵ���̶ȴ�����ˮ��̶ȡ���Na2SO3��Һ�Լ�������Ϊˮ��ʹ��Һ�ʼ��ԣ������ӷ���ʽΪSO32-��H2O HSO3��+OH�������ɱ������ݿ�֪����n(SO3��)=n(HSO3��)ʱ��pH=7.2����ˣ�������Һ������ʱ��c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH�������ɵ���غ��֪��c��Na����=2c��SO32-����c��HSO3��������������Һ������Ũ�ȹ�ϵ��ȷ����ab ��
��3����������� SO2�����������ķ�ӦΪ2SO2��g��+O2��g��![]() 2SO3��g��������T1����0.1MPa�����£���һ�ܱ�����ͨ��SO2��O2������n��SO2����n��O2��=2��1��������n��SO2��=2x mol��n��O2��=x mol����Ӧ��ת����Ϊ
2SO3��g��������T1����0.1MPa�����£���һ�ܱ�����ͨ��SO2��O2������n��SO2����n��O2��=2��1��������n��SO2��=2x mol��n��O2��=x mol����Ӧ��ת����Ϊ![]() ����Ӧ�ﰴ��ѧ������֮��Ͷ��ʱ����Ӧ���ת������ͬ������SO2��O2��SO3�ı仯���ֱ�Ϊ2x
����Ӧ�ﰴ��ѧ������֮��Ͷ��ʱ����Ӧ���ת������ͬ������SO2��O2��SO3�ı仯���ֱ�Ϊ2x![]() mol��x
mol��x![]() mol����2x
mol����2x![]() mol��SO2��O2��SO3��ƽ�����ֱ�Ϊ2x
mol��SO2��O2��SO3��ƽ�����ֱ�Ϊ2x![]() mol��x
mol��x![]() mol��2x
mol��2x![]() mol���ڷ�Ӧǰ��ѹǿ֮�ȵ�����������ʵ���֮�ȣ����ԣ�A����
mol���ڷ�Ӧǰ��ѹǿ֮�ȵ�����������ʵ���֮�ȣ����ԣ�A����![]() ����֮�ã�
����֮�ã�![]() .
.
��ͼ��A��ʱ��SO2��ת����Ϊ45%��
���������������������£����T2��ʱѹǿ�ı仯������ͼ��ʾ����ͼ���֪����T2�淴Ӧ����ƽ�����õ�ʱ����٣���T1��T2���¶�Խ�ߣ���ѧ��Ӧ����Խ�죬C��ΪT2��ƽ��״̬��A��ΪT1������������Ӧ������еķ�ƽ��״̬�����ԣ�C�������Ӧ����vc��������A����淴Ӧ����vA���棩�Ĵ�С��ϵΪvc��������vA ���棩��
����ͼ����Ϣ��֪��B����܈RΪ0.07MPa����![]() ����֮��
����֮��![]() ��
��
��SO2��O2��SO3��ƽ�����ֱ�Ϊ0.2x mol��0.1x mol��1.8x mol��SO2��O2��SO3�����ʵ��������ֱ�Ϊ![]() ��
��![]() ��
��![]() ��SO2��O2��SO3��ƽ���ѹ�ֱ�Ϊ
��SO2��O2��SO3��ƽ���ѹ�ֱ�Ϊ![]() ��
��![]() ��
��![]() �����Ը÷�Ӧ��ѹǿƽ�ⳣ��kp=
�����Ը÷�Ӧ��ѹǿƽ�ⳣ��kp=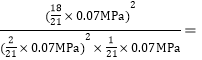 24300��MPa��-1��
24300��MPa��-1��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ��ܳ�ʱ�䱣���ȶ��ķŵ��ѹ�������ܷ�ӦΪ��3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH��������������ȷ����
3Zn(OH)2 + 2Fe(OH)3 + 4KOH��������������ȷ����
A. �ŵ�ʱ������ӦΪ��Zn-2e-+2OH-= Zn(OH)2
B. ���ʱ��������������Ӧ��������Һ������ǿ
C. ���ʱÿת��3mol���ӣ�������1.5molZn����
D. �ŵ�ʱ������ӦΪ��FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HA ΪһԪ���ᡣ��֪��Һ��HA��A-�����ʵ�������������ҺpH�仯��������ͼ��ʾ����10 mL0.1mol/LHA��Һ�У��μ�0.1mol/LNaOH��Һx mL������˵���У�����ȷ����

A. pH=9ʱ��c(A-)=c(HA)
B. x=0ʱ��1
C. HA�ĵ���ƽ�ⳣ��ka=10-5
D. x=10ʱ��c(A-)+c(HA)=c(Na+)=0.05mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������أ�����˵����ȷ����
A. ���ڡ��л����������ά�����л��߷��ӻ�����
B. ���к��зḻ�ĵ����ʣ�������к��ʱ�Ϊ�˰�����
C. ���ͺϳ���ά����Ҫ�ɷ־�Ϊ��ά��
D. �������Ʊ�Ⱦ�ϡ�ҽҩ��ũҩ�ȵķ������ʿ���Դ��ú�ĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ����ͻ�ѧ���������ȷ����
A. 0.5molFe�ͺ�1 mol HNO3��ϡ��Һ��ַ�Ӧ����KSCN��Һ����Һ���
B. Fe(OH)3��������Ӿʵ��ʱ������������ɫ�����֪Fe(OH)3����������
C. ����143�����ӵ�U(92��)ԭ�ӵ�ԭ�ӷ��ţ� ![]() U
U
D. 1mol H3PO3������2 mol NaOH�����кͷ�Ӧ�����Na2HPO3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧҩƷ���ض��ı��淽ʽ��������������ȷ����
A. �Ʊ�����ϸ��ƿ�в���ú��Һ��
B. ������ˮ��������ɫƿ�в������䰵��
C. NaOH��Һ��������ɫ�Լ�ƿ�в�Ҫ��������
D. ����������Һ����ڼ����������۵��Լ�ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)������������ȷ����( )
4NO(g)+6H2O(g)������������ȷ����( )
A. �ﵽ��ѧƽ��ʱ��4v��(O2)=5v��(NO)
B. ����λʱ��������xmol NO��ͬʱ������xmolNH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʵĹ�ϵ��2v��(NH3)=3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ����������Һʱ���ɲ��������ЧӦ��������������Һ���� ( )
A.������B.��ҺC.����D.��Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com