
【题目】(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比 。
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO) + c(CH3COOH)= mol/L
c(H+) c(CH3COO) - c(CH3COOH) +2c(OH) (填“>”、“<”或“=”)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是 。
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是 。
【答案】(1) 1:10:1010:109 (2)0.1 <
(3)c(CH3COO-)>c(Na+)>c(H+)>c(OH-) (4)1:10
【解析】
试题分析:(1)设溶液的体积为1L,①中pH=0的H2SO4中c(H+)=1.0 molL-1,c(OH-)=1.0×10-14molL-1,水电离的物质的量为1.0×10-14mol;②中c(OH-)=0.1 molL-1,c(H+)=1.0×10-13molL-1,水电离的物质的量为1.0×10-13mol;③中c(OH-)=1.0×10-4molL-1,水的电离的物质的量为1.0×10-4mol;④中c(H+)=1.0×10-5molL-1,水的电离的物质的量为1.0×10-5mol;故①②③④中水的电离的物质的量之比为:1.0×10-14mol:1.0×10-13mol:1.0×10-4mol1:1.0×10-5mol=1:10:1010:109;
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后: c(CH3COO) + c(CH3COOH)= 0.1mol/L
根据质子守恒有:c(H+) + c(CH3COOH)=c(CH3COO) +c(OH),移项得 c(H+)=c(CH3COO) - c(CH3COOH) +c(OH) ,则c(H+)<c(CH3COO) - c(CH3COOH) +2c(OH);(3)pH=3的醋酸与pH=11的氢氧化钠溶液混合后,醋酸为弱酸,所以醋酸过量,溶液显示酸性,氢离子浓度大于氢氧根离子浓度c(H+)>c(OH-),根据电荷守恒可知,c(Na+)<c(CH3COO-),即c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(4)pH=2的H2SO4溶液中c(H+)=10-2mol/L,pH=11的NaOH溶液中c(OH-)=![]() mol/L=10-3mol/L,两溶液恰好中和,则n(H+)=n(OH-),所以Vac(H+)=Vbc(OH-),所以Va:Vb=c(OH-):c(H+)=10-3mol/L:10-2mol/L=1:10.
mol/L=10-3mol/L,两溶液恰好中和,则n(H+)=n(OH-),所以Vac(H+)=Vbc(OH-),所以Va:Vb=c(OH-):c(H+)=10-3mol/L:10-2mol/L=1:10.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇燃料分为甲醇汽油和甲醇柴油,工业合成甲醇的方法很多。
(1)一定条件下发生反应:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1
2CO(g)+O2(g)═2CO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
则CO(g)+2H2(g)CH3OH(g)的△H═ _________.
(2)在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图1所示,该反应的△H____0 (填>、<或=).
(3)若要提高甲醇的产率,可采取的措施有(填字母)___________
A.缩小容器体积
B.降低温度
C.升高温度
D.使用合适的催化剂
E.将甲醇从混合体系中分离出来

(4)CH4和H2O在催化剂表面发生反应CH4+H2OCO+3H2,T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50%,计算该温度下上述反应的化学平衡常数_____________________(结果保留小数点后两位数字)
(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图2是目前研究较多的一类固体氧化物燃料电池工作原理示意图,B极的电极反应式为_________
(6)25℃时,草酸钙的Ksp=4.0×10﹣8,碳酸钙的Ksp=2.5×10﹣9。向10ml碳酸钙的饱和溶液中逐滴加入8.0×10﹣4molL﹣1的草酸钾溶液10ml,能否产生沉淀__________(填“能”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①![]() Li 、②
Li 、②![]() N 、③
N 、③![]() Na 、④
Na 、④![]() Mg 、⑤
Mg 、⑤![]() Li 、⑥
Li 、⑥![]() C 、⑦C60 、⑧石墨中,
C 、⑦C60 、⑧石墨中,
选择序号填空。
(1) 和 质量数相等,但不能互称同位素;
(2) 和 的中子数相等,但质子数不相等,所以不是同一种元素;
(3) 和 互为同素异形体。
(4)________和______互为同位素。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为___________;
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:___________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g)![]() H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
H2(g)+I2(g)的△H=+11kJmol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___________ kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:

①根据上述实验结果,该反应的平衡常数K的计算式为:___________;
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___________(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=___________min-1.
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为___________(填字母).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、氧、磷、铁是与生命活动密切相关的元素。回答下列问题:
(1)P的基态原子最外电子层具有的原子轨道数为 ,Fe3+比Fe2+稳定的原因是 。
(2)N、O、P三种元素第一电离能最大的是 ,电负性最大的是 。
(3)含氮化合物NH4SCN溶液是检验Fe3+的常用试剂,SCN-中C原子的杂化类型为 ,1mol SCN-中含π键的数目为 NA。
(4)某直链多磷酸钠的阴离子呈如图所示的无极单链状结构,其中磷氧四面体通过共有顶角氧原子相连,则该多磷酸钠的化学式为 。
![]()
(5)FeO、NiO的晶体结构均与氯化钠晶体结构相同、其中Fe2+和Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm,则熔点FeO NiO(填“<”、“>”或“=”)原因是 。
(6)磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示。P原子与B原子的最近距离为acm,则磷化硼晶胞的边长为 cm。(用含a的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2![]() 6H2O(M=392g
6H2O(M=392g![]() mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
Ⅰ.莫尔盐的制取
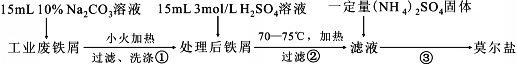
回答下列问题:
(1)步骤②必须在剩余少量铁屑时进行过滤,其原因是 。(用离子方程式表示)
(2)制取的莫尔盐最后要用 洗涤(填字母编号),其目的是: 。
a.蒸馏水 b.乙醇 c.滤液
(3)从下图中选取必须用的仪器连接成实验室制取(NH4)2SO4溶液的装置,连接的顺序(用接口字母表示)是_____________。
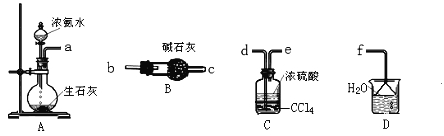
Ⅱ.FAS纯度测定
为测定FAS纯度,取m g样品配制成500 mL溶液,根据物质组成,甲、乙两位同学设计了如下两个实验方案。
(1)甲方案:取20.00 mLFAS溶液,用0.1000 mol·L-1 的酸性K2Cr2O7 溶液进行滴定。
i)写出此反应的离子方程式: 。
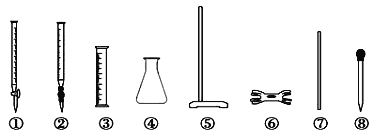
ii) 滴定时必须选用的仪器是 。
(2)乙方案:取20.00 mLFAS溶液进行如下实验。
![]()
列出计算FAS晶体纯度的代数式 (不用计算出结果)。
(3)已知实验操作都正确,却发现甲方案的测定结果总是小于乙方案,其可能的原因是 ,设计简单的化学实验验证上述推测 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号B:_________ C:_________
(2)BA2的电子式 _________ ,BA2分子中化学键属于_________ 键。
(3)D2A2的化学式 _________ ,灼烧这化合物火焰呈_________ 色。
(4)C在元素周期表中的位置是第_________周期,_______族,其原子结构示意图为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2 L 容积不变的密闭容器内,800 ℃时反应 2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如下表:
2NO2 (g)体系中,n(NO)随时间的变化如下表:

(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v=________________。若上述反应在850 ℃下进行,反应2s时 n(NO)=0.009 mol,并且不再随时间而改变,则该反应是__________热反应。

(2)图中表示NO2浓度变化的曲线是__________(填字母)。
(3)能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
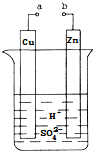
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com