
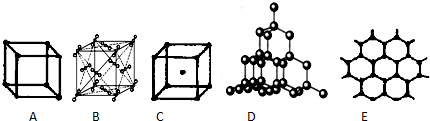
分析 (1)金刚石是空间网状结构,每个碳原子连接4个碳原子,原子间以共价键相结合,据此答题;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形,据此答题;
(3)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;
(4)根据各种物质的熔点:原子晶体>离子晶体>分子晶体以及在离子晶体里,半径越大,晶格能越小,熔点越低解答.
解答 解:(1)在金刚石晶胞中,每个碳可与周围4个碳原子形成共价键,将这4个碳原子连结起来后可以形成正四面体,体心有一个碳原子,所以图D为金刚石,每个碳原子与4个碳原子最近且距离相等;金刚石是空间网状结构,属于原子晶体;
故答案为:D;4;原子;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形,所以图E为石墨的结构,每个正六边形占有的碳原子数平均为6×$\frac{1}{3}$=2;故答案为:E;2;
(3)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体;
故答案为:B;分子;12;
(4)各种物质的熔点:原子晶体>离子晶体>分子晶体,石墨的熔点大于金刚石,在离子晶体里,半径越大,晶格能越小,熔点越低,由于铯离子半径大于钠离子,石墨的熔点大于金刚石,所以熔点由高到低的排列顺序为:金刚石>CsCl>干冰;
故答案为:金刚石>CsCl>干冰.
点评 本题主要考查了各种常见类型的晶体的结构,以及各种晶体的性质,难度不大,解题的关键是要对基本知识要熟记尤其是结构图.


科目:高中化学 来源: 题型:多选题
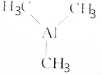 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )| A. | 三甲基铝的摩尔质量是72 | |
| B. | 14.4g三甲基铝中碳原子数为0.6NA | |
| C. | 0.5mol三甲基铝的质量为36g•mol-1 | |
| D. | 1mol三甲基铝在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液可能存在K+、SO42- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液肯定只存在NH4+、SO32- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com