
| A. | 100 g•mol-1 | B. | 108 g•mol-1 | C. | 55 g•mol-1 | D. | 96 g•mol-1 |
 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 10mL0.10mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) | |
| C. | 在NaHCO3溶液中加入等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- | |
| D. | 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的名称2,3-二甲基戊烷
的名称2,3-二甲基戊烷查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与石灰乳反应制漂白粉 | B. | 钠在氯气中燃烧生成氯化钠 | ||
| C. | 氯化铵与氢氧化钙共热制氨气 | D. | 浓盐酸与二氧化锰共热制氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2FeO4中Fe显+8价,具有强氧化性,所以能杀菌消毒 | |
| B. | 因为Na2FeO4溶液显碱性,所以能杀菌消毒 | |
| C. | Na2FeO4的还原产物为Fe3+,其易水解产生Fe(OH)3胶体,使水中悬浮物聚沉 | |
| D. | Na2FeO4的还原产物Fe2+ 水解,生成的胶体使水中悬浮物沉降,从而达到消毒目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜属于重金属,但其盐有毒,所以铜质器皿不安全,应该禁用 | |
| B. | 食盐、食醋和味精是常用的食品添加剂,其主要化学成分均属钠盐 | |
| C. | 氨气液化以及液氨气化均要吸收大量的热,所以氨常用于制冷剂 | |
| D. | SO2能使食物增白,但这类食物会严重损害人体的肝肾,所以食品中应该严格限量使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 标准状况下,22.4 L氨水含有NA个NH3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
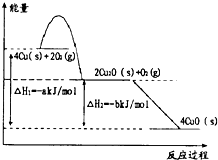 铜及其化合物在工业、农业、科技和日常生活中有广泛应用.
铜及其化合物在工业、农业、科技和日常生活中有广泛应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com