
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】A
【解析】A. 据图可知,加入40mLNaHCO3溶液时生成沉淀最多,沉淀为0.032mol,因NaOH过量,则滤液中含有NaOH,由反应顺序OH+HCO3=CO32+H2O、HCO3+AlO2+H2O═Al(OH)3↓+ CO32并结合图象可知,加入前8mLNaHCO3溶液时不生成沉淀,则原NaHCO3溶液中c(NaHCO3)= ![]() =1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
=1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
【题型】单选题
【结束】
8
【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。
)。
反应如下: +ClC(CH3)3
+ClC(CH3)3 +HCl
+HCl
已知下列信息:
物质 | 相对分子质量 | 密度 | 熔点 | 沸点 | 溶解性 |
AlCl3 | —— | —— | 190℃ | 180℃ | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88g/cm3 | —— | 80.1℃ | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.84 g/cm3 | —— | 51.6℃ | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 g/cm3 | —— | 169℃ | 难溶于水,易溶于苯 |
I、如下图是实验室制备无水AlCl3的实验装置:

(1)E装置中的仪器名称是_______________。
(2)写出B装置中发生反应的离子方程式:________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________ (写导管口标号)。
(4)下列操作正确的是________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:_______________________。
II、实验室制取叔丁基苯装置如图:

在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是___________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是_____________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为______。(保留3位有效数字)
【答案】 干燥管 MnO2+4H++2C1-=Mn2++Cl2↑+2H2O d、e、f、g、h、i、j、c 乙 防止空气中的水蒸气进入,还吸收多余的氯气 使液体顺利滴下 干燥 ②①③ 75.0%
【解析】I.(1). E装置中的仪器名称是干燥管,故答案为:干燥管;
(2). 在B装置中,浓盐酸和MnO2反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl=Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl=Mn2++Cl2↑+2H2O;
(3). B装置产生的氯气中混有氯化氢和水蒸气杂质,用D装置除去HCl 杂质,C装置除去水蒸气杂质,由于氯化铝易升华,产生的氯化铝颗粒易堵塞导气管,所以得到纯净的氯气后在F装置中和铝反应制取氯化铝而不用A装置,根据信息可知氯化铝遇水极易潮解并产生白色烟雾,所以最后必须用E装置吸收多余的氯气并可以防止空气中的水蒸气进入F装置中,因此制备无水氯化铝正确的连接顺序为d、e、f、g、h、i、j、c,故答案为:d、e、f、g、h、i、j、c;
(4). 制备无水氯化铝时,应先加热圆底烧瓶产生氯气,将装置中的空气排尽,以防止铝粉被空气中的氧气氧化,故答案为:乙;
(5). 由上述分析可知,用E装置可以吸收多余的氯气并能防止空气中的水蒸气进入F装置中使氯化铝潮解,故答案为:防止空气中的水蒸气进入,还吸收多余的氯气;
II. (6). 使用恒压漏斗可以平衡漏斗内外压强,使液体顺利滴下,在洗涤后所得产物中加入少量无水MgSO4固体,目的是吸收产品中少量的水分,起到干燥的作用,故答案为:使液体顺利滴下;干燥;
(7). 稀盐酸洗涤可以除去氯化铝杂质,再用5%Na2CO3溶液除去过量的盐酸,最后用水洗涤除去剩余的5%Na2CO3,故答案为:②①③;
(8).加入苯的物质的量为50mL×0.88g/mL÷78g/mol=0.56mol,氯代叔丁烷的物质的量为10mL×1.84g/mL÷92.5g/mol=0.199mol,由反应方程式 +ClC(CH3)3
+ClC(CH3)3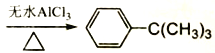 +HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:
+HCl可知,加入的苯过量,则理论上生成叔丁基苯的质量为:0.199mol×134g/mol=26.66g,叔丁基苯的产率为:![]() ×100%=75.0%,故答案为:75.0%。
×100%=75.0%,故答案为:75.0%。


科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国。金属钨可用于制造灯丝、超硬模具和光学仪器。在工业上常采用高温还原WO3法制取金属钨。回答下列问题:
(1)白钨矿(主要成分是CaWO4)与盐酸反应生成沉淀,灼烧沉淀即可得到WO3,上述两步反应的化学方程式为_________________、__________________。
(2)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下: WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) △H=_________,K=__________。
W(s)+3H2O(g) △H=_________,K=__________。
(3)T1℃时,将一定质量WO3和8.0gH2置于2L密闭容器中,发生反应: WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①T1℃时,H2的平衡转化率a=_________%,反应平衡常数K=__________。
②若在4min时降低并维持温度为T2℃,则该反应的△H_______0,若在8min时缩小容器容积,则![]() _________1.3。(填“>”“ <”或“=”)
_________1.3。(填“>”“ <”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了如下实验:

(1)该同学的实验目的是_____________________________;
(2)上图③操作步骤为________________,④加入试剂为 ;
(3)按此实验方案得到的NaCl固体中肯定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
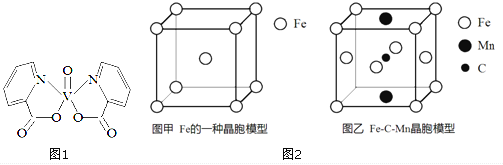
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。
【答案】 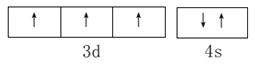 O>N>C>H C、N 2NA bcd 体心立方密堆积
O>N>C>H C、N 2NA bcd 体心立方密堆积 ![]() 4 Fe23Mn8C8
4 Fe23Mn8C8
【解析】I. (1). V是23号元素,其价层电子排布式为3d34s2,价层电子轨道表示式为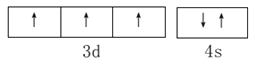 ,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为:
,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为: ;O>N>C>H;
;O>N>C>H;
(2). 由图1可知,该分子中的C原子和N原子的σ键数均为3且没有孤电子对,所以C原子和N原子的杂化轨道数目均为3,采取sp2杂化,由图1可知,V与N原子之间形成配位键,1个分子中含有2个配位键,则1mol分子中含有2mol配位键,数目为2NA,故答案为:C、N;2NA;
(3). 该物质是电中性分子,分子之间存在范德华力,由图1可知,该物质的晶体中除配位键外,分子内的不同非金属原子之间形成极性共价键,同种非金属原子之间形成非极性共价键,不存在金属键和氢键,故答案为:bcd;
II. (4). 由Fe的晶胞结构示意图可知,晶胞中Fe的堆积方式为体心立方密堆积,晶胞中Fe原子的个数为:8×![]() +1=2,则晶胞的质量为:
+1=2,则晶胞的质量为:![]() ×56g,设晶胞的棱长为x cm,则
×56g,设晶胞的棱长为x cm,则![]() ×56g=ρg·cm-3×(x cm)3,解得x=
×56g=ρg·cm-3×(x cm)3,解得x=![]() cm,故答案为:体心立方密堆积;
cm,故答案为:体心立方密堆积;![]() ;
;
(5). 由图乙可知,体心的C原子与面心的Fe原子距离最近,则与C原子等距紧邻的Fe原子个数为4,该晶胞中Fe原子个数为7×![]() +4×
+4×![]() =
=![]() ,C原子个数为1,Mn原子数目为2×
,C原子个数为1,Mn原子数目为2×![]() =1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
=1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
点睛:本题主要考查物质结构和性质,涉及电子排布式、电负性、杂化方式、配合物、晶胞结构和有关计算,试题难度不大。本题的易错点是第(5)小题,在利用均摊法计算晶胞中原子个数时,要注意该晶体有缺陷,即有一个顶点未排列Fe原子。
【题型】综合题 【题目】香料G的一种合成工艺如下图所示。
【结束】
12
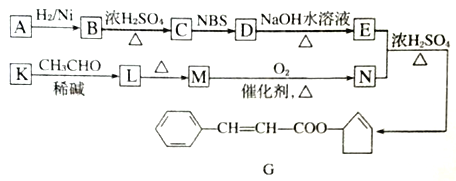
A 的分子式为C5H8O其核磁共振氢谱显示有两种峰。其峰面积之比为1: 1.
已知:CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_________。
(2)A的结构简式为_______。
(3)写出下列转化的化学方程式:D→E_____________________
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有____种。(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_______、________。
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个取代基
(6) 以2-丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)__________。
请用以下方式表示: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下的四种溶液:①pH=2的醋酸;②pH=a的Na2CO3溶液,体积为VL;③pH=2的硫酸;④pH=12的氢氧化钠溶液.下列有关说法正确的是( )
A.将②溶液用蒸馏水稀释,使体积扩大十倍,所得溶液pH变为a﹣1
B.V1L③和V2L④混合,若混合后溶液pH=3,则V1:V2=11:9
C.①与④等体积混合后,混合液pH=7
D.①与③两溶液的物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和一气态单烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水的质量增加2.8g,此2种烃是( )
A.甲烷和丙烯
B.甲烷和2﹣丁烯
C.甲烷和2﹣甲基丙烯
D.乙烯和1﹣丁烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com