
【题目】砷及其化合物在半导体、农药制造等方面用途非常广泛。回答下列问题:
(1)ASH3的电子式为___;AsH3通入AgNO3溶液中可生成Ag, As2 O3和HNO3,该反应中氧化剂与还原剂的物质的量之比为___。
(2)改变O. 1 mol · L-1三元弱酸H3 AsO4溶液的pH,溶液中的H3 AsO4、H2 AsO4-、HAsO42-以及AsO43-的物质的量分布分数随pH的变化如图所示:

①1gKal ( H3 AsO4)=___;用甲基橙作指示剂,用NaOH溶液滴定H3 ASO4发生的主要反应的离子方程式为___
②反应H2 AsO4-+AsO43-=2HAsO42-的lgK=_____
(3)焦炭真空冶炼砷的其中两个热化学反应如下:
As2O3(g)+3C(s)=2As(g)+3CO(g) ![]() H1=akJ/mol
H1=akJ/mol
As2O3(g)+3C(s)=1/2As4(g)+3CO(g) ![]() H2=bkJ/mol
H2=bkJ/mol
则反应4As(g)=As4(g)![]() H=_______kJ/mol(用含a、b的代数式表示)。
H=_______kJ/mol(用含a、b的代数式表示)。
(4)反应2As2S3(s)=4AsS(g)+S2(g)达平衡时气体总压的对数值lg(p/kPa)与温度的关系如图所示:

①对应温度下,B点的反应速率v(正) ___v(逆)(填“>’,’’<”或“一”)。
②A点处,AsS(g)的分压为___kPa,该反应的Kp=___kPa5 (Kp为以分压表示的平衡常数)。
【答案】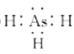 6:1 —2.2
6:1 —2.2 ![]() 4.5 2b—2a > 0.8 8.192×10-2
4.5 2b—2a > 0.8 8.192×10-2
【解析】
(1)ASH3的电子式与氨气类似;AsH3通入AgNO3溶液中可生成Ag,As2O3和HNO3,反应为2AsH3+12AgNO3+3H2O═As2O3+12Ag↓+12HNO3,据此分析;
(2)三元弱酸H3AsO4的三级电离反应为:H3AsO4H++H2ASO4-,H2ASO4-H++HAsO42-,HAsO42-H++AsO43-,
①Kal(H3AsO4)=![]() ,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,可得,用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,据此书写;
,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,可得,用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,据此书写;
②同理,Ka2(H2ASO4-)=![]() ,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=
,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=![]() ,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
反应H2AsO4-+AsO43-2HAsO42-的K=![]() =
=![]() ×
×![]() =
= ![]() ,据此计算;
,据此计算;
(3)已知:Ⅰ、As2O3(g)+3C(s)=2As(g)+3CO(g)△H1= akJmol-1
ⅡAs2O3(g)+3C(s)=![]() As4(g)+CO(g)△H2 = b kJmol-1
As4(g)+CO(g)△H2 = b kJmol-1
根据盖斯定律:Ⅱ×2-Ⅰ×2得反应4As(g)As4(g),据此计算;
(4)①A点达到平衡,B点处气体总压小于平衡时的气压,据此分析;
②A点处,气体总压的对数值lg(p/kPa),则气体总压为1kPa,AsS(g)在气体中体积分数为![]() ,由此可得;得出平衡时AsS(g)的分压为和S2(g)的分压,再计算Kp。
,由此可得;得出平衡时AsS(g)的分压为和S2(g)的分压,再计算Kp。
(1)ASH3的电子式与氨气类似,电子式为: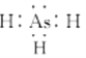 ;AsH3通入AgNO3溶液中可生成Ag,As2O3和HNO3,反应为2AsH3+12AgNO3+3H2O═As2O3+12Ag↓+12HNO3,其实As元素化合价升高被氧化,AsH3为还原剂,Ag元素化合价降低被还原,AgNO3为还原剂,氧化剂与还原剂的物质的量之比为6:1;
;AsH3通入AgNO3溶液中可生成Ag,As2O3和HNO3,反应为2AsH3+12AgNO3+3H2O═As2O3+12Ag↓+12HNO3,其实As元素化合价升高被氧化,AsH3为还原剂,Ag元素化合价降低被还原,AgNO3为还原剂,氧化剂与还原剂的物质的量之比为6:1;
故答案为: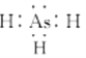 ;6:1;
;6:1;
(2)三元弱酸H3AsO4的三级电离反应为:H3AsO4H++H2ASO4-,H2ASO4-H++HAsO42-,HAsO42-H++AsO43-,第一步电离为主,
①Kal(H3AsO4)=![]() ,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,则1gKal(H3AsO4)=-2.2;用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,离子反应为:H3AsO4+OH-=H2ASO4-+H2O;
,根据图可知,pH=2.2时,c(H2ASO4-)=c(H3AsO4),则Kal(H3AsO4)=c(H+)=10-2.2,则1gKal(H3AsO4)=-2.2;用甲基橙作指示剂,用NaOH溶液滴定H3ASO4发生反应生成NaH2ASO4,离子反应为:H3AsO4+OH-=H2ASO4-+H2O;
故答案为:-2.2;H3AsO4+OH-=H2ASO4-+H2O;
②同理,Ka2(H2ASO4-)=![]() ,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=
,pH=7时,c(H2ASO4-)=c(HAsO42-),则Ka2(H2AsO4-)=c(H+)=10-7,Ka3(HAsO42-)=![]() ,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
,pH=11.5时,c(HAsO42-)=c(AsO43-),则Ka3(HAsO42-)=c(H+)=10-11.5,
反应H2AsO4-+AsO43-2HAsO42-的K=![]() =
=![]() ×
×![]() =
= ![]() =
=![]() =104.5,lgK═4.5;
=104.5,lgK═4.5;
故答案为:4.5;
(3)已知:Ⅰ、As2
ⅡAs2O3(g)+3C(s)=![]() As4(g)+CO(g)△H2=b kJmol-1
As4(g)+CO(g)△H2=b kJmol-1
根据盖斯定律:Ⅱ×2-Ⅰ×2得4As(g)As4(g)△H=(2b-2a)kJmol-1;
故答案为:2b-2a;
(4)①A点达到平衡,B点处气体总压小于平衡时的气压,说明生成气体比平衡时少,反应正向着正方向生成气体的方向进行,故B点的反应速率v(正)>v(逆);
故答案为:>;
②A点处,气体总压的对数值lg(p/kPa),则气体总压为1kPa,AsS(g)在气体中体积分数为![]() ,S2(g)在气体中体积分数为
,S2(g)在气体中体积分数为![]() ,则AsS(g)的分压为0.8kPa,S2(g)的分压为0.2kPa,Kp=(0.8kPa)4×0.2kPa=8.192×10-2kPa5;
,则AsS(g)的分压为0.8kPa,S2(g)的分压为0.2kPa,Kp=(0.8kPa)4×0.2kPa=8.192×10-2kPa5;
故答案为:0.8;8.192×10-2。


科目:高中化学 来源: 题型:
【题目】298K时,将0.1mol·L-1的两种钠盐NaX、NaY溶液加水稀释,溶液的pH 与稀释倍数的对数![]() 的关系如图所示.下列说法不正确的是
的关系如图所示.下列说法不正确的是

A. 酸性:HY>HX
B. 298K时,K(HX)/ K(HY)= 1/100
C. ![]() =2时,c(HX)+c(X- )=c(HY)+c(Y- )
=2时,c(HX)+c(X- )=c(HY)+c(Y- )
D. 相同浓度时,NaX和NaY两溶液中离子总浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g) ![]() 2Z(g)ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是
2Z(g)ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是
A.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,消耗0.2 mol X,生成0.4 mol Z
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A. 生成1 mol C5 H12至少需要4 mol H2
B. 该分子中所有碳原子在同一平面内
C. 三氯代物只有一种
D. 与其互为同分异构体,且只含碳碳三键的链烃有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是由4个圆所构成的元素概念的关系图,其中4为最大圆,3、2、1依次减小。试判断符合这种关系的是

A. 1.最基本元素、2.基本元素、3.主要元素、4.大量元素
B. 1.大量元素、2.主要元素、3.基本元素、4.最基本元素
C. 1.基本元素、2.最基本元素、3.大量元素、4.主要元素
D. 1.主要元素、2.大量元素、3.最基本元素、4.基本元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Kw=1.0×10-12,若在该温度时,某溶液的c(H+)=1.0×10-7molL-1,则该溶液
A. 呈酸性 B. 呈碱性 C. 呈中性 D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:
①0.1mol/LNH4Cl②0.1mol/LCH3COONH4③0.1mol/LNH4HSO4
④0.1mol/LNH4HCO3 ⑤0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液①呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(2)溶液⑤呈 ______ 性(填“酸”、“碱”或“中”),其原因是: ______ (用离子方程式表示)
(3)比较溶液①、③中c(NH4+)的大小关系是① ______ ③(填“>”、“<”或“=”)
(4)常温下,测得溶液②的pH=7,则CH3COO-的水解程度 ______ NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_____c(NH4+)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20 mL 0.01 mol·L-1HA(aq)中不断滴入0.02 mol·L-1 NaOH(aq),混合溶液pH变化如图所示。此过程溶液下列说法不正确的是(已知:25℃时一元酸HA(aq)电离平衡常数Ka=1.6×10-5)

A. a点溶液的pH大于3
B. b点溶液中离子:c(A-)>c(Na+)>c(H+)>c(OH-)
C. c点表示酸HA(aq)和NaOH(aq)溶液恰好完全反应
D. d点溶液加水稀释后c(H+)/c(HA)的值会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型动力电池( LiFePO4电池)总反应式为Li1-xFePO4+LixC6![]() C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是
C6+LiFePO4,内部结构如图1所示,只有Li+通过聚合物隔膜。以此电池电解Na2SO4溶液(电极材料为石墨),可制得NaOH和H2SO4,其原理如图2所示。下列说法错误的是

A. 电池放电时,LixC6在负极发生氧化反应
B. 电池放电时,正极反应式为 Lil-xFePO4+xLi-+xe-= LiFePO4
C. 电解时,图2的b电极反应式为2H2O-4e-=O2↑+4H+
D. 电解时,当转移0.2mol电子,A口产生气体的质量1.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com