
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
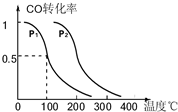
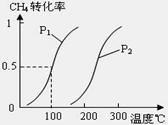
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
⑵在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a=________、b=_______。
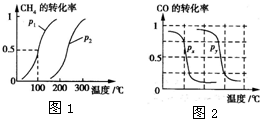
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
(共14分)⑴①0.0030 mol/(L·min)(2分) ②< (2分)2.25×10-4(2分)③> (2分)
⑵④BD(2分) A.a=150,b=1/3 B. 0.1
解析:⑴①由100℃平衡CH4的转化率为0.5可知,消耗CH4、H2O各0.5mol,生成H21.5mol,生成CO0.5mol,故其反应速率v (H2)=1.5/(5×100)=0.0030mol/(L·min)。
100℃时平衡常数K=(0.015)3×0.005/(0.005×0.015)= 2.25×10-4。②在相同温度下,在P1条件下CH4的转化率大,即有利于反应正向进行,可得P1<P2。③由于温度升高CH4的转化率增大,即有利于反应正向进行,故该反应正反应为吸热反应。⑵④选项A中化学平衡逆向进行,产率降低。选项C在恒容条件下化学平衡不发生移动,产率不变。选项B和D均使化学平衡正向移动,产率增加。⑤显然该同学通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得只a=150,b=1/3。由于题给反应是一个气体体积缩小的反应,压强越大CH4的转化率也大,由此可得Px=0.1MPa。


科目:高中化学 来源: 题型:
 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) | ||
| l | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1| 1 |
| 2 |
| 1 |
| 2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| 4a2 |
| V2 |
| 4a2 |
| V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | ρ(MPa) | ||
| 1 | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
⑵在压强为0.1 MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
 ⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
查看答案和解析>>
科目:高中化学 来源:2011届宁夏银川一中高三上学期第五次月考(理综)化学部分 题型:填空题
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。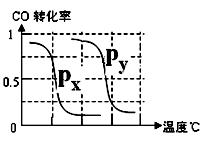
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.则上表中剩余的实验条件数据:a="________ " b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com