
【题目】综合利用海水可以制备氯化铵、纯碱、金属镁等物质,其流程如下图所示:
 (1)反应①~⑤中,属于氧化还原反应的是__________(填编号)
(1)反应①~⑤中,属于氧化还原反应的是__________(填编号)
(2)写出反应②的离子方程式_______________
(3)X溶液中的主要阳离子是Na+和___________
(4)已知氨气极易溶于水,实验室可用NH4Cl和Ca(OH)2固体混合加热制取。根据流程原理制取碳酸氢钠固体,下列实验装置正确且能达到实验目的的是_________

A.用装置甲制取氨气
B.用装置乙制取二氧化碳
C.用装置丙制取碳酸氢钠
D.用装置丁分离碳酸氢钠固体与母液
(5)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:
①溶解;②依次滴加过量的BaCl2溶液、NaOH溶液、Na2CO3溶液;③______________;④滴加适量盐酸;⑤_____________________(请补全缺少的实验操作)
(6)检验纯碱样品中是否含NaCl,至少应选用的试剂是____________________
(7)电解熔融氯化镁制镁,得到的镁蒸气可在下列哪种气体氛围中冷却(填序号)________________
A.H2 B.CO2 C.O2 D.N2
【答案】 ⑤ Mg (OH)2+2H+ = Mg2+ + 2H2O NH![]() C 过滤 蒸发结晶 稀硝酸、AgNO3溶液 A
C 过滤 蒸发结晶 稀硝酸、AgNO3溶液 A
【解析】试题分析:本题以海水的综合利用为题材,重点考查学生对氧化还原反应的判断、离子方程式、Mg的化学性质等基础知识掌握情况,考查常见气体制备装置的选择、过滤、NH3的溶解、粗盐的提纯、离子检验等实验基础操作,考查学生对实验流程分析能力。
解析:(1)海水提纯粗盐后,母液中MgCl2与石灰乳反应生成Mg(OH)2,MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2,该反应不属于氧化还原反应;②反应为Mg(OH)2+2HCl=MgCl2+2H2O,该反应也不属于氧化还原反应;③通过蒸发浓缩、冷却结晶、过滤、洗涤等一系列操作得到氯化镁晶体;④在一定条件下去除结晶水得到无水氯化镁;⑤反应原理为MgCl2(熔融)![]() Mg+Cl2↑,该反应属于氧化还原反应。正确答案⑤。(2)②离子方程式改写过程中Mg(OH)2、H2O不能改写成离子。正确答案:Mg (OH)2+2H+ =Mg2++2H2O。(3)粗盐提纯后得到纯NaCl,通入NH3、CO2后得到NaHCO3和NH4Cl,所以阳离子是Na+和NH4+。正确答案:NH4+。(4)A、NH3是通过固体加热制备的,但是选用装置试管口应当略向下倾斜,防止H2O倒流进试管使试管炸裂,A错误。B、制备CO2不能选用稀硫酸,防止生成的CaSO4包裹在CaCO3外面影响反应进一步进行,B错误。C、右侧的干燥管可以防止NH3溶于水发生倒吸,C正确。D、过滤时固体和液体的混合物需要用玻璃棒引流导入漏斗中,D错误。正确答案:C。(5)在粗盐提纯过程中,通过②使杂质离子充分沉淀后,由于生成的Mg(OH)2、CaCO3能够溶解在盐酸中,所以加入盐酸之前需要过滤除去沉淀。正确答案:过滤。(6)检验纯碱样品中是否含NaCl就是检验是否含有Cl-,一般方法是取样溶于水,先加入少量稀硝酸酸化溶液,再加AgNO3溶液,如果有白色沉淀则说明样品中含有NaCl,反之不存在NaCl。正确答案:稀硝酸、AgNO3溶液 。(7)电解得到的镁蒸气能够与CO2、O2、N2反应,所以应该在H2中冷却。正确答案:A。
Mg+Cl2↑,该反应属于氧化还原反应。正确答案⑤。(2)②离子方程式改写过程中Mg(OH)2、H2O不能改写成离子。正确答案:Mg (OH)2+2H+ =Mg2++2H2O。(3)粗盐提纯后得到纯NaCl,通入NH3、CO2后得到NaHCO3和NH4Cl,所以阳离子是Na+和NH4+。正确答案:NH4+。(4)A、NH3是通过固体加热制备的,但是选用装置试管口应当略向下倾斜,防止H2O倒流进试管使试管炸裂,A错误。B、制备CO2不能选用稀硫酸,防止生成的CaSO4包裹在CaCO3外面影响反应进一步进行,B错误。C、右侧的干燥管可以防止NH3溶于水发生倒吸,C正确。D、过滤时固体和液体的混合物需要用玻璃棒引流导入漏斗中,D错误。正确答案:C。(5)在粗盐提纯过程中,通过②使杂质离子充分沉淀后,由于生成的Mg(OH)2、CaCO3能够溶解在盐酸中,所以加入盐酸之前需要过滤除去沉淀。正确答案:过滤。(6)检验纯碱样品中是否含NaCl就是检验是否含有Cl-,一般方法是取样溶于水,先加入少量稀硝酸酸化溶液,再加AgNO3溶液,如果有白色沉淀则说明样品中含有NaCl,反之不存在NaCl。正确答案:稀硝酸、AgNO3溶液 。(7)电解得到的镁蒸气能够与CO2、O2、N2反应,所以应该在H2中冷却。正确答案:A。


科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
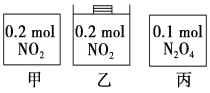
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施,是为了防止产生雾霾的,其中不可行的是
A. 停止冬季供暖,减少有害物质排放
B. 对锅炉和汽车等产生的有害气体和烟尘等进行处理
C. 退耕还林,改善生态环境
D. 寻找新能源,减少化石燃料的使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl + Mg=Mg2+ + 2Ag + 2Cl--。有关该电池的说法正确的是( )
A.可用于海上应急照明供电 B.负极反应AgCl + eˉ= Ag + Cl--
C.不能被KCl 溶液激活 D.Mg为电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表1﹣20号元素的性质和递变规律,回答下列问题.
(1)属于金属元素的有种,金属性最强的元素与氧反应生成的化合物有和(填两种化合物的化学式即可).
(2)属于稀有气体的是(填元素符号,下同).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到相应实验目的的是
A. 用pH试纸测定新制氯水的pH
B. 用酒精代替CCl4来萃取溴水中的Br2
C. 用向上排气法收集亚硫酸钠与浓硫酸反应产生的SO2
D. 直接加热氯化铵并用向下排气法收集NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。

(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1mol H—H键、1mol I—I、1mol H—I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将___ ___转化为___ _____。
(3)50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题:

①从实验装置上看,图中尚缺少的一种玻璃用品是 .
②烧杯间填满碎纸条的作用是 .
③大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”或“无影响”).
④实验中改用60mL 0.50molL﹣1盐酸跟50 mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
⑤用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com