
| A. | 3:1:1 | B. | 2:2:1 | C. | 3:4:3 | D. | 7:13:5 |
分析 设CO、甲烷和丁烷的物质的量为x、y、z,根据碳守恒,完全燃烧生成二氧化碳的物质的量分别为:为x、y、4z,则:$\left\{\begin{array}{l}{x+y+z=\frac{11.2L}{22.4L/mol}}\\{x+y+4z=\frac{17.92L}{22.4L/mol}}\end{array}\right.$,由此分析解答.
解答 解:设CO、甲烷和丁烷的物质的量为x、y、z,根据碳守恒,完全燃烧生成二氧化碳的物质的量分别为:为x、y、4z,则:$\left\{\begin{array}{l}{x+y+z=\frac{11.2L}{22.4L/mol}}\\{x+y+4z=\frac{17.92L}{22.4L/mol}}\end{array}\right.$,解之得z=0.1mol,所以x+y=0.4mol,则$\frac{x+y}{z}=\frac{0.4}{0.1}$=$\frac{4}{1}$,即A、B、D符合条件,而C不符合,故选C.
点评 考查常用化学计量的有关计算,难度不大,注意基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
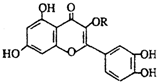 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )| A. | 1mol天然维生素P在一定条件下最多与7molH2加成 | |
| B. | 1mol天然维生素P和溴水反应,可消耗6molBr2 | |
| C. | 可用有机溶剂萃取 | |
| D. | 1mol维生素P可以和4mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:Li<Na<K<Rb<Cs | B. | 熔点、沸点:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li<Na<K<Rb<Cs | D. | 氧化性:Li+<Na+<K+<Rb+<Cs+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
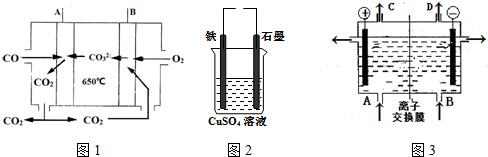
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50% | B. | 48.8% | C. | 42.1% | D. | 72.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一般来说,酸、碱、盐是电解质,非金属氧化物是非电解质 | |
| B. | 常见弱电解质有弱酸、弱碱、水等 | |
| C. | 强电解质的水溶液导电能力一定强,弱电解质的水溶液导电能力一定弱 | |
| D. | 蔗糖、酒精都属于非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
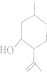 )是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).
)是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).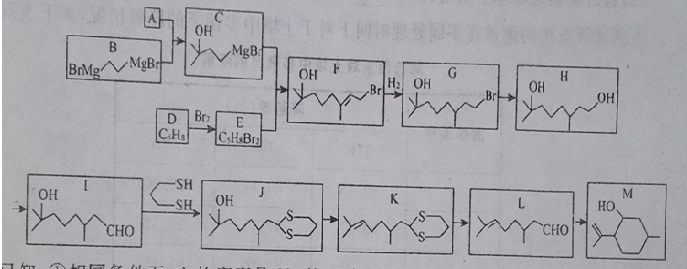
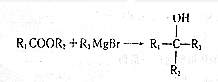
 .
.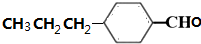 (写出其中任意一种的结构简式).
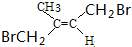
(写出其中任意一种的结构简式).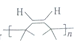 的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$
的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$ (无机试剂任选).
(无机试剂任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com