
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl(g)+O2(g)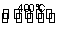 2Cl2(g)+2H2O(g),可实现氯的循环利用。已知4 mol HCl被氧化可放出115.6 kJ的热量。下列说法正确的是( )
2Cl2(g)+2H2O(g),可实现氯的循环利用。已知4 mol HCl被氧化可放出115.6 kJ的热量。下列说法正确的是( )
A.该反应的热化学方程式是4HCl(g)+O2(g) 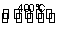 2Cl2(g)+2H2O
2Cl2(g)+2H2O
ΔH=-115.6 kJ·mol-1
B.将36.5 g HCl(g)和8 g O2(g)充入一密闭容器中发生反应,反应放热28.9 kJ
C.加入催化剂,该化学反应的反应热改变
D.在温度、体积一定的条件下,通入4 mol HCl和1 mol O2反应后放出的热量为Q1kJ,若通入8 mol HCl和2 mol O2反应后放出的热量为Q2kJ,则231.2>Q2>2Q1
选D。由4 mol HCl被氧化,放出115.6 kJ的热量,可知该反应的反应热ΔH=-115.6 kJ·mol-1,未标H2O的状态,A错误;该反应是可逆反应,不能完全转化成Cl2(g)和H2O(g),故反应放热小于28.9 kJ,B错误;加入催化剂,反应的反应热不变,C错误;通入4 mol HCl和1 mol O2完全反应时放出的热量为115.6 kJ,但该反应 是可逆反应,该条件下放出的热量小于115.6 kJ;故8 mol HCl和2 mol O2在该条件下放出的热量小于231.2 kJ,两情况对比由于体积相同,8 mol HCl和2 mol O2相当于对于4 mol HCl和1 mol O2先等效再加压,平衡右移,放出热量更多,故有231.2>Q2>2Q1,故D正确。
是可逆反应,该条件下放出的热量小于115.6 kJ;故8 mol HCl和2 mol O2在该条件下放出的热量小于231.2 kJ,两情况对比由于体积相同,8 mol HCl和2 mol O2相当于对于4 mol HCl和1 mol O2先等效再加压,平衡右移,放出热量更多,故有231.2>Q2>2Q1,故D正确。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式__________________________________。某赤铁矿除了含Fe2O3之外,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应后过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是______________________________________________________________。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量稀盐酸,然后滴加KSCN溶液,若出现红色,证明含有Fe2O3。否则,不含有Fe2O3。你认为该方案合理吗?为什么?__________________________________ __________________________________。
(3)合成氨工业中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为12时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:2Fe2O3+C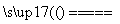 4FeO+CO2↑。
4FeO+CO2↑。
实验教师提供了12 g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023mol—1,下列叙述中正确的是( )
A.常温常压下,18.0 g重水(D2O)所含的电子数约为10×6.02×1023
B.室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C.标准状况下,22.4 L苯所含的分子数约为6.02×1023
D.标准状况下,a L乙烷气体中的所含共价键数约为(a/22.4)×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的铁与1L含0.4molHNO3的溶液恰好完全反应生成NO,则被还原的HNO3的物质的量为( )
A.0.4mol B.0.3mol C.0.lmol D.条件不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A经下图所示的过程转化为含氧酸D,D为强酸,请回答下列问题:
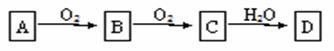
(1)若A在常温下为气体单质则回答:
①A、C的化学式分别是:A________;C________。
②将C通入水溶液中,反应化学方程式为_____________________________________________。
(2)若仅A、B在常温下为气体且为化合物, 则回答:
①A的化学式是:A_____________。
②B生成C的化学方程式为________________________________________________________。
③一定条件下碳单质与D反应的化学方程式为________________________________________,该反应中D起到的作用是__________性。
(3)若A在常温下为固体单质则回答:
①D的化学式是___________;
②向含2mol D的浓溶液中加入足量的Cu加热,标准状况下产生的气体体积_______22.4L(填“大于”“等于”或“小于”),原因为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.图甲是一定的温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):_____________。
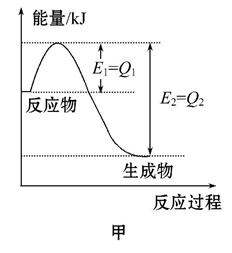
Ⅱ.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,
已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
2H2(g)+O2(g)====2H2O(l) ΔH=-571.6 kJ·mol-1,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=____________;
4NH3(g)+3O2(g) ΔH=____________;
(2)饮用水中的N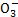 主要来自于N
主要来自于N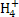 。已知在微生物的作用下,N
。已知在微生物的作用下,N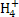 经过两步反应被氧化成N
经过两步反应被氧化成N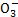 。两步反应的能量变化示意图如图乙:
。两步反应的能量变化示意图如图乙:
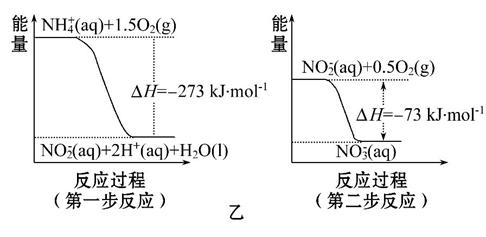
1 mol N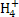 全部被氧化成N
全部被氧化成N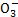 的热化学方程式为___________________________。
的热化学方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是( )
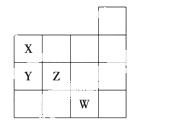
①X、Y的最高价氧化物对应的水化物的酸性Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成 离子化合物,由此可知
离子化合物,由此可知
| W | X | |
| Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是 ( )。
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是释放能量的反应
C.干冰气化需要吸收大量的热,这个变化是吸热反应
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com