
(11分)A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是 。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为 。
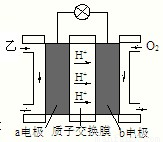
(3)由A、D组成的最简单化合物甲的二氯化物有 种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为: 。
(4)已知反应:DE(g)+A2E(g) DE2(
DE2( g)+A2(g),
g)+A2(g),
一定条件下该反应进行过程中的能量变 化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=
化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=  。
。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为 。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |

查看答案和解析>>
科目:高中化学 来源:2011年福建师大附中高考化学模拟试卷(解析版) 题型:解答题
| 物 质 | 甲 | 乙 | 丙 |
| 浓度/mol?L-1 | 0.01 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是 。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为 。
(3)由A、D组成的最简单化合物甲的二氯化物有 种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为: 。
(4)已知反应:DE(g)+A2E(g)![]() DE2(g)+A2(g),
DE2(g)+A2(g),
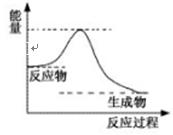
一定条件下该反应进行过程中的能量变化如上图表示,请结合上图判断:该反应△H 0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K= 。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com