
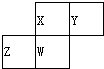
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 气态氢化物的稳定性:Z>W>X>Y | |
| C. | W的最高正化合价与负化合价的绝对值不可能相等 | |
| D. | Z的最高价氧化物的水化物可能为强碱 |
分析 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期,
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
C.W处于第三周期,可能处于ⅣA族或ⅤA或ⅥA族,最高正价=族序数,最低负化合价=族序数-8;
D.Z至少处于ⅢA族,氢氧化铝为弱碱.
解答 解:如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素,由于ⅡA、ⅢA族在周期表中之间相隔10列,故Z至少处于ⅢA族,Y最多处于ⅦA,且X、Y处于第二周期,Z、W处于第三周期,
A.同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大,则原子半径大小为:Z>W>X>Y,故A正确;
B.同周期元素从左到右非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,且元素的非金属性越强,对应氢化物的稳定性越大,则气态氢化物的稳定性:Y>X>W>Z,故B错误;
C.如W为Si,则四种元素分别为C、N、Al、Si,W的最高正化合价与负化合价的绝对值相等,故C错误;
D.Z的最高价氧化物的水化物可能为:Al(OH)3、H2SiO3、H3PO4,则Z的最高价氧化物的水化物为弱碱或弱酸,故D错误;
故选A.
点评 本题考查元素周期表与元素周期律综合应用,注意ⅡA、ⅢA族在周期表中之间相隔10列,二者在周期表中不相邻,学生容易忽略,为易错题目.


科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏法分离碘和酒精 | |
| B. | 稀硝酸除去混在铜粉中的少量镁粉和铝粉 | |
| C. | 用溶解,过滤的方法分离硝酸钾和氯化钠固体的混合物 | |
| D. | 用饱和氯化铁溶液滴入煮沸的氢氧化钠溶液中的方法制备氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
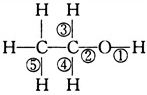 ,关于乙醇在各种不同反应中断键的说法正确的是( )
,关于乙醇在各种不同反应中断键的说法正确的是( )| A. | 和金属钠反应键②断裂 | |
| B. | 在Cu催化下和O2反应键①④断裂 | |
| C. | 和浓硫酸共热140℃时,键①或键②断裂,170℃时键②⑤断裂 | |
| D. | 和氢溴酸反应键①断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是两种核素 | |
| B. | 纤维素和淀粉互为同分异构体 | |
| C. | CH3COOCH2CH3和CH3CH2OOCCH3是同物质 | |
| D. | CH3CH2COOH可看成是由-C2H5和-COOH两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的NaCl晶体不能导电,但NaCl是电解质 | |
| B. | 食盐水能导电,所以食盐水是电解质 | |
| C. | 三氧化硫溶于水能导电,所以三氧化硫是电解质 | |
| D. | 一种物质如果不是电解质,那么它一定是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
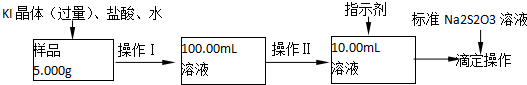
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com