

| A. | ①② | B. | ②④ | C. | ④⑤ | D. | ③⑤ |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④ | C. | ①③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
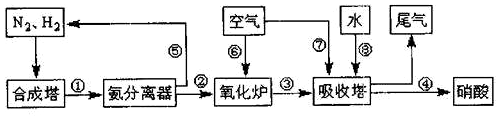

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | 2a=b | C. | 4a=3b | D. | 2a=3b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C26 H22 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物的一氯代物有5种 | |
| D. | 该有机物既可发生氧化反应,又可发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| B. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 氧化铝具有很高的熔点,故可用于制造阻燃剂或耐高温材料 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故其混合物的漂白效果会更好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com