
| A、25℃时,0.1 mol/LHF溶液中pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
| [F-]2 |
| [HF] |
| [F-]2 |
| [HF] |


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
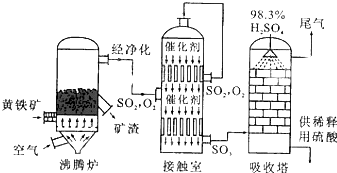 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:
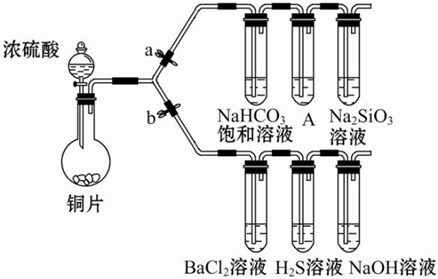
查看答案和解析>>
科目:高中化学 来源: 题型:
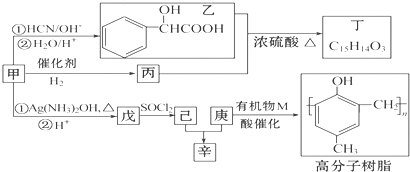
| ①HCN/OH- |
| ②H2O/H+ |
| SOCl2 |
| R′OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中阴极没有气体生成 |
| B、电解过程中转移的电子的物质的量为0.4 mol |
| C、原CuSO4溶液的浓度为0.1 mol?L-1 |
| D、电解过程中阳极收集到的气体体积为1.12 L(标况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:
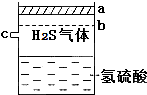 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu(Fe)--稀盐酸,过滤 |
| B、KNO3(NaCl)--结晶 |
| C、水(NaCl)--蒸馏 |
| D、CO2(HCl)--氢氧化钠溶液,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别加入碘水,观察颜色反应 |
| B、分别加热,观察是否生成沉淀 |
| C、加入淀粉酶观察是否水解 |
| D、分别灼烧,闻味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熵变小于零而焓变大于零的反应肯定不能发生 |
| B、用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |
| C、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com