
���� ��1��������Ŀ������ʽ�������������ת��������ת����=$\frac{���ʵ�ת����}{���ʵ���ʼ��}$��100%����ת���ʣ����ݻ�ѧƽ�ⳣ�������б���ʽ��
��2���������ڵ�Чƽ�⣬���º��ݣ����ݵ�Чƽ�⣬ת��Ϊͬ�����ʱ�ʾͶ������ͬ���㣮
��� �⣺��1���÷�ӦΪ��N2+3H2?2NH3����������ʽ��
N2+3H2?2NH3
��ʼ����mol��1 2 0
ת������mol��0.3 0.9 0.6
ƽ������mol��0.7 1.1 0.6
��N2��ת������$\frac{0.3mol}{1mol}$��100%=30%���÷�Ӧ��ƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}��•{c}^{3}��{H}_{2}��}$��
�ʴ�Ϊ��30%�� K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}��•{c}^{3}��{H}_{2}��}$��
��2����ͬ�¶��£�������ͨ��1molNH3���ұ����ݻ������ͬ������Ӧ�ﵽƽ��ʱ�������ʵ�Ũ�����ƽ������ͬ����������ڵ�Чƽ�⣬����Ϊͬ������Ͷ������ȣ�������ͨ��1molNH3���ɷ���ʽ��֪�൱��0.5molN2��1.5molH2���軹��Ͷ�뵪��x����y����x+0.5=1��y+1.5=2����x=0.5��y=0.5��
�ʴ�Ϊ��0.5��0.5��
���� ���⿼���˻�ѧƽ�����ؼ��㣬����Ĺؼ�����ȷ��Чƽ��ĺ����Լ��ж����ݣ�Ȼ��������������ü��ɣ�����������ѧ���������������ͳ���˼ά������


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��пת����ͭ�������ӷ���ʽΪZnS��s��+Cu2+��aq��=Zn2+��aq��+CuS��s�� | |
| B�� | �ڰ�ɫ��п��Һ�еμ�����Ǧ��Һ���������ɺ�ɫ������PbS�� | |
| C�� | ��ˮ�е��ܽ�ȣ�S��ZnS����S��PbS����S��CuS�� | |
| D�� | ����Һ��c��Cu2+��=1��10-10mol•L-1����S2-����ȫת����CuS |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
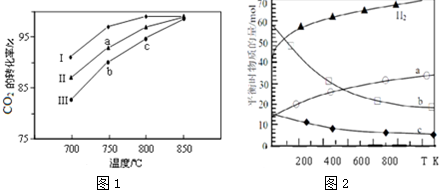
 д�����з�Ӧ���Ȼ�ѧ����ʽ
д�����з�Ӧ���Ȼ�ѧ����ʽ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.0 mol/L | B�� | 0.50 mol/L | C�� | 1.0 mol/L | D�� | 0.10 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�����Ǽ��ȵķ�Ӧ�������ȷ�Ӧ | |
| B�� | ��ѧ��Ӧ���������µ������⣬ͨ���ų������� | |
| C�� | ����ȼ��һ���Ƿ��ȷ�Ӧ | |
| D�� | ���ȵĻ�ѧ��Ӧ����Ҫ���Ⱦ��ܷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ϊ��������ܸ�ʴ���ڴ��������װ������п�飬��Ϊ�������������������� | |
| B�� | ԭ��ع���ʱ�������ķ��������������ء�������ԭ����е������Һ������ | |
| C�� | �����ڿ����о��ñ�ڷ������ǻ�ѧ��ʴ | |
| D�� | ������Ʒ�϶�ͭʱ������Ʒ����Ƴص�������ͭ��Ϊ���Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com