
| A. | N2O | B. | NO | C. | NO2 | D. | N2 |
分析 在氧化还原反应中氧化剂得到的电子数等于还原剂失去的电子数,根据转移电子数相等确定还原产物中N元素的化合价,从而确定还原产物.
解答 解:假设金属元素化合价由0价变为+1价,设还原产物中N元素化合价为x,根据转移电子相等得2×(1-0)=1×(5-x),x=3;
假设金属元素化合价由0价变为+2价,设还原产物中N元素化合价为y,根据转移电子相等得2×(2-0)=1×(5-y),y=1;
假设金属元素化合价由0价变为+3价,设还原产物中N元素化合价为z,根据转移电子相等得2×(3-0)=1×(5-z),z=-1;
A.N2O中N元素化合价为+1,所以符合,故A正确;
B.NO中N元素化合价为+2价,不符合,故B错误;
C.NO2中N元素化合价为+4价,不符合,故C错误;
D.N2中N元素化合价为0价,不符合,故D错误;
故选A.
点评 本题考查氧化还原反应计算,侧重考查学生发散思维能力及计算能力,利用转移电子守恒解答即可,注意:金属单质未知,所以其化合价要讨论,为易错点.


科目:高中化学 来源: 题型:解答题
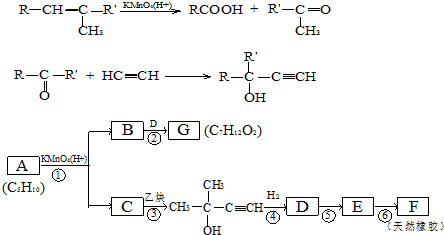
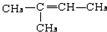 ,CCH3COCH3,ECH2=C(CH3)CH=CH2
,CCH3COCH3,ECH2=C(CH3)CH=CH2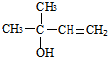 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$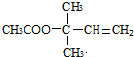 +H2O;
+H2O; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第ⅣA族 | |
| B. | 原子半径:X<R<T | |
| C. | 最简单气态氢化物稳定性:T>R>Y | |
| D. | 最高价氧化物的水化物酸性:T>R>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化为溶解度更小的沉淀 | |
| C. | AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 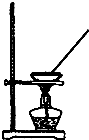 如图所示装置获得碳酸氢钠固体 | B. | 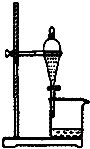 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 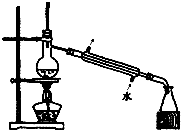 如图所示装置制取少量蒸馏水 | D. | 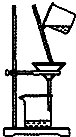 如图所示装置提纯氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在:K+、Na+、AlO2-、SO42- | |
| B. | 向1 mo1•L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| C. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001 mol•L-1,c(CO32-)=0.0001 mol•L-1,此时Mg2+和CO32-不能共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com