
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下, [已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1]
2NH3(g) △H=-92.4kJ·mol-1]
容器 | 甲 | 乙 | 丙 |
反应物投入量 | lmolN2 、3molH2 | 2mol NH3 | 4mol NH3 |
NH3的浓度(mol/L) | cl | c2 | c3 |
反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | a1 | a2 | a3 |
下列说法正确的是
A. a1+a3<1 B. a+b>92.4 C. 2p2<p3 D. 2c1>c3
【答案】A
【解析】A.丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,转化率α1+α3=1;由于丙中相当于增大压强,平衡正向移动,氨气的转化率减小,所以转化率α1+α3<1,故A正确;B.甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故a+b=92.4,故B错误;C.丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3,故C错误;D.甲容器和乙容器是达到等效平衡状态,甲正向进行,乙逆向进行,则c1=c2,丙对乙来讲,相当于乙压缩体积为原来的一半形成的,增大压强时,平衡正向移动,则2c1<c3,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
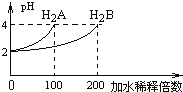
A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氨(NH2OH )为一元弱碱(25℃时,电高常数Kb=9.0×10-9),其电离方程式为NH2OH+H2O ![]() NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是( )
NH3OH++OH-。 25℃时,用0.100mol· L-1盐酸滴定20mL0.100mol· L-1NH2OH溶液,滴定过程中水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(已知:lg3=0.5) 。下列说法不正确的是( )
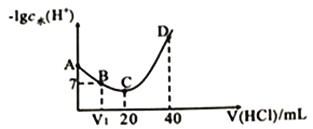
A. V1<10
B. A点对应溶液的pH=9.5
C. A 、B、C 、D四点对应的溶液中NH2OH电离常数相等
D. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如表中的两组数据:
实验编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | 8 |
下列说法不正确的是
A. x=1.6
B. 实验1在前6min 的反应速率v (SO2)=0.2mol·L-1·min-1
C. T1、T2的关系:T1>T2
D. K1、K2的关系:K1 >K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙醛的说法错误的是( )
A. 一个乙醛子有6个σ键,1个π键
B. 乙醛分子中存在非极性键
C. 乙醛在催化剂铜存在下可以氧化生成乙醇
D. 乙醛晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2mol氢气完全燃烧生成水蒸气时放出能量484kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出能量463kJ,则氢气中1molH-H键断裂时吸收热量为( )
A.920kJB.557kJC.436kJD.188kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工.作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应式为16Li+xS8=8Li2Sx(2≤x≤8)。同时利用此装置的电能在铁上镀铜,下列说法不正确的是
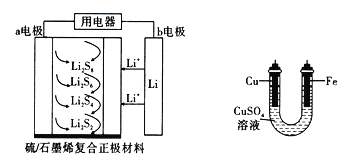
A. 电池工作时,a是正极,外电路中流过0.02mol电子,负极材料减重0.14g
B. 石墨烯的作用主要是提高电极a的导电性
C. 当钾硫电池电极提供1mol电子时,则理论上铁电极增重32g
D. 放电时,Li+向正极移动,在此电池中加人硫酸可增加导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所需的三大营养物质。以下叙述正确的是( )
A.植物油不能使溴的四氯化碳溶液褪色B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应D.蚕丝、羊毛、棉花的主要成分都是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)____________。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)_____________________。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是__________,上述离子浓度大小顺序关系中正确的是(选填序号)_________________________。
②若上述关系中C是正确的,则溶液中溶质的化学式是___________________________。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)_____________c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)____________c(Cl-)。
(4)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①_______________和______________两种粒子的物质的量之和等于0.1mol。
②_______________和______________两种粒子的物质的量之和比OH―多0.05mol。
【答案】 D C 氯化铵 A NH4Cl和HCl < = NH3H2O NH4+ NH4+ H+
【解析】(1)一水合氨为弱电解质,存在电离平衡,稀释后一水合氨的电离程度增大,溶液中氢氧根离子的物质的量增大,所以将pH=11的氨水稀释100倍后,稀释后的溶液中氢氧根离子浓度大于原来的1%,溶液的pH应该9-11之间,故选D;
(2)氯化铵溶于水电离出铵根离子,使氨水中的铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,故答案为:C;
(3)①因任何水溶液中都有OH、H+,若溶质只有一种则为NH4Cl,因NH4+水解,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即A符合。故答案为:氯化铵;A;
②C中离子关系可知溶液显酸性,且c(Cl)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl。故答案为:NH4Cl和HCl;
③NH4Cl是强酸弱碱盐其水溶液呈酸性,盐酸与氨水混合,要溶液呈中性,则氨水应稍微过量,所以n(HCl)<n(NH3·H2O)。因为盐酸和氨水的体积相等,则c(HCl)<c(NH3·H2O)。溶液呈中性,则c(H+)=c(OH),溶液呈电中性,所以溶液c(NH4+)=c(Cl-)。
故答案为:<,=。
(3)根据N原子守恒可知,溶液中NH3H2O和NH4+两种粒子的物质的量之和等于0.1mol,故答案为:NH3H2O;NH4+;
②根据电荷守恒式c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),则c(NH4+)+c(H+)-c(OH-)=c(Cl-)-c(Na+)=0.1mol-0.05mol。
故答案为:NH4+;H+.
【题型】综合题
【结束】
25
【题目】(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____________________;
(2)向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是有气泡,并有白色沉淀生成,有关的离子方程式________________________.
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方式与氨相似,联氨第一步电离反应的平衡常数值为________________ (已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_________。
(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图3是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。

②由图可得Fe(OH)2的溶度积的值为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com