
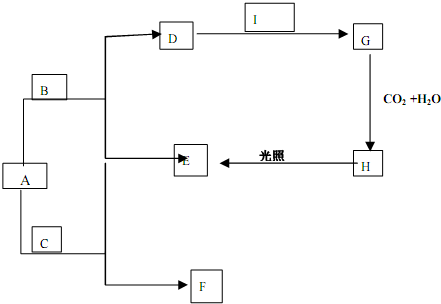
分析 现有A、B、C、D、E、F、G、H、I几种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,则A为Na2O2,A能与C反应得到E与F,且C为气体,E为气体单质,可推知C为CO2,F为Na2CO3,F的水溶液与澄清石灰水混合可制得D的溶液,则D为NaOH,而A与B反应得到D,故B为H2O,I为气体单质,能与氢氧化钠溶液反应得到G,G与二氧化碳、水反应得到H,H光照可以生成氧气,可推知I为Cl2,G为NaClO,H为HClO,据此解答.
解答 解:现有A、B、C、D、E、F、G、H、I几种物质,其中A、B、C均为氧化物,且A为淡黄色粉末,则A为Na2O2,A能与C反应得到E与F,且C为气体,E为气体单质,可推知C为CO2,F为Na2CO3,F的水溶液与澄清石灰水混合可制得D的溶液,则D为NaOH,而A与B反应得到D,故B为H2O,I为气体单质,能与氢氧化钠溶液反应得到G,G与二氧化碳、水反应得到H,H光照可以生成氧气,可推知I为Cl2,G为NaClO,H为HClO.
(1)由上述分析可知,A为Na2O2,G为NaClO,H为HClO,故答案为:Na2O2;NaClO;HClO;
(2)A+B→D+E的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,
F+Ca(OH)2→D的离子方程式:CO32-+Ca2+=CaCO3↓,
D+I→G的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;CO32-+Ca2+=CaCO3↓;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查无机物推断,涉及Na、Cl元素单质化合物性质,“淡黄色粉末A与气体C反应得到气体单质E”是推断突破口,需要学生熟练注意元素化合物知识,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫粉和铁粉的混合物 | B. | 氯化氢和溴化氢的混合物 | ||
| C. | 溴和CCl4的混合物 | D. | 碘与食盐的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50% | B. | 60% | C. | 75% | D. | 86% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才发生的化学反应,反应物的总能量可能高于生成物的总能量 | |
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=-270 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 已知:C(s,金刚石)═C(s,石墨)△H=-1.5 kJ•mol-1,说明金刚石更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入石灰石 | B. | 光照 | C. | 加入固体NaOH | D. | 加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | NaOH | C. | NaHCO3 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=+57.3 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热为110.5 kJ•mol-1 | |
| D. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com