
| A、0.5molCO2 |
| B、常温常压下48gO2 |
| C、标准状况下22.4LH2 |
| D、2NA个水分子 |
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
| B、氯化钠晶体中,每个Na+周围距离相等的Na+共有12个 |
| C、氯化艳晶体中,每个Cs+周围紧邻8个Cl- |
| D、干冰晶体中,每个CO2分子周围紧邻10个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为实现2008京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的l6种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )
为实现2008京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的l6种兴奋剂.已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如右图所示.下列叙述中正确的是( )| A、该物质可以视为酚类 |
| B、在浓硫酸作用下,分子内消去一个水分子,产物有二种同分异构体 |
| C、能使溴的四氯化碳溶液褪色 |
| D、该物质分子中的所有碳原子均共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 右图是冰醋酸(醋酸晶体)加水溶解并不断稀释过程中溶液导电能力与加入水的体积的变化关系,试回答:
右图是冰醋酸(醋酸晶体)加水溶解并不断稀释过程中溶液导电能力与加入水的体积的变化关系,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.0045mol?L-1? | <100个?mL-1? |
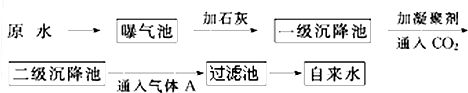
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1mol乙烯共用电子对数为4NA | ||
| B、1molD318O+中含有的中子数为10NA | ||
C、标准状况下,1L戊烷充分燃烧后生成气态产物的分子数为
| ||
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com