
| A. | 分别配成溶液,再加入澄清石灰水 | |
| B. | 分别配成溶液,再加入CaCl2溶液 | |
| C. | 分别加热,再检验是否有使澄清石灰水变浑浊的气体产生 | |
| D. | 分别取固体样品,滴加同浓度盐酸,观察产生气泡的快慢 |
分析 NaHCO3不稳定,加热易分解,与酸反应较Na2CO3剧烈,二者都能与澄清石灰水反应生成沉淀,碳酸钠可与氯化钙反应生成沉淀,以此解答该题.
解答 解:A.二者都能与澄清石灰水反应生成沉淀,不能鉴别,故A错误;
B.Na2CO3与CaCl2反应生成白色沉淀,碳酸氢钠不能,能鉴别,且操作简单,故B正确;
C.NaHCO3不稳定,加热易分解,生成气体可使澄清石灰水变浑浊,可鉴别,故C正确;
D.逐滴加入等浓度的稀盐酸,碳酸氢钠溶液中有气体生成,碳酸钠溶液中开始无气体生成,随加入盐酸增多,后来生成气体,现象不同,可以鉴别,故D正确.
故选A.
点评 本题考查碳酸钠与碳酸氢钠的性质探究,侧重于基础知识的考查,题目难度不大,注意把握二者性质的异同,易错点为C,注意反应现象的把握.


科目:高中化学 来源: 题型:选择题
| A. | 为了区别一般的化学方程式 | B. | 物质的状态与反应热有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| B. | 室温下水电离的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Al3+、NO3-、I- | |
| D. | 无色溶液中:Al3+、NH4+、Cl?、HCO3? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| D. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
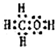 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液 | B. | NaOH溶液 | C. | 氨水 | D. | 石蕊试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述过程中可以得出结论,氧化性:HNO3>稀H2SO4>Fe3+ | |
| C. | 上述过程中,会产生一种无色无味的难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则同温同压下,SO2和逸出气体的体积为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+ |
| 阴离子 | OH-、HCO3-、CO32-、Cl-、NO3-、SO42- |
| A. | 由①、②判断,溶液中一定不含有的阳离子是K+、Fe3+ | |
| B. | 实验③中的气体不可能为CO2 | |
| C. | 综合分析判断,原溶液中所含的离子为:Fe2+、Mg2+、Cl-、NO3-、SO42- | |
| D. | 若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、灼烧至恒重,得到的固体质量为8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当有0.1mol电子转移时,a极产生1.12L O2(标况) | |
| B. | b极上发生的电极反应是:2H++2e-═H2↑ | |
| C. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上进行还原反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com