
| A. | 标准状况下,22.4 L HF中含有的氟原子数目为NA | |
| B. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
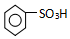
| C. | 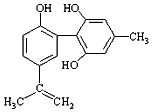 1mol如图物质与浓溴水反应时通常最多消耗Br2为4mol | |
| D. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,一定条件下,使用催化剂能加快反应速率并提高反应 物的平衡转化率 |
分析 A.气体摩尔体积使用对象为气体;
B.0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全,则两者的物质的量之比为1:1;
C.依据此有机物中含的碳碳双键和酚羟基判断,酚羟基的邻位和对位能被溴原子取代;
D.如反应能自发进行,应满足△H-T•△S<0;催化剂不能改变平衡移动;
解答 解:A.标况下,HF为液体,不能使用气体摩尔体积,故A错误;
B.0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全,则两者的物质的量之比为1:1,两者反应所得的溶液为氨水溶液,还得到BaSO4沉淀,故溶液中的离子浓度为:c(OH-)>c(NH4+)>c(H+)>c(SO42-),故B错误;
C.苯环上酚羟基的邻对位氢原子能被溴原子取代,溴能和碳碳双键发生加成反应,所以1 mol该物质与浓溴水反应时最多消耗Br2为4 mol,故C正确;
D.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,△G=△H-T△S,△S>0,△G>0,故该反应△H>0,催化剂只能改变化学反应的速率,对化学平衡不产生影响,故D错误;
故选:C.
点评 本题为综合题,考查了物质的量有关计算、离子浓度大小比较、有机物结构与性质、反应自发进行方向判断、催化剂对化学反应速率、平衡的影响,熟悉相关知识是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol NaH参加反应失去1mol电子 | B. | 每生成1mol H2转移2mol电子 | ||
| C. | NaH既是氧化剂,又是还原剂 | D. | NaOH是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Cl-,MnO4-,SO42- | B. | Na+,SiO32-,NO3-,CO32- | ||
| C. | Na+,NO3-,SO42-,HCO3- | D. | Na+,SO42-,S2-,ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 62g白磷(白磷P4为正四面体结构P原子位于顶点)中含P-P共价键为6NA | |
| B. | 1molCl2全部发生反应时,无论什么时候都是得到的电子数一定为2NA | |
| C. | 若一个CO的质量为a g,则CO的摩尔质量为a NA | |
| D. | 常温下10LpH=13的NaOH溶液中含有的OH-离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个H2O 分子所占体积约为22.4L | |
| B. | 0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
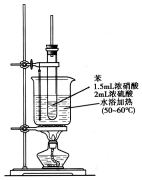 纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.
纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.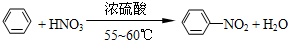 .
. ),导致硝基苯的产率下降.写出发生副反应的化学方程式
),导致硝基苯的产率下降.写出发生副反应的化学方程式 +H2SO4(浓)$\stackrel{△}{→}$
+H2SO4(浓)$\stackrel{△}{→}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
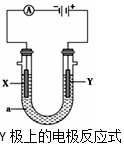 电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:
电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com