
【题目】某复合材料是由碳纤维为增强体、金属钛为基体复合而成的。估计这种材料( )
①耐高温 ②不耐热 ③导电、导热 ④不导电、不导热 ⑤可用于飞机机翼 ⑥可用于导弹的壳体
A.①③⑤⑥
B.②③⑤⑥
C.②③④
D.③④⑤
科目:高中化学 来源: 题型:
【题目】25℃时,在20.0 mL 0.10mol/L 氨水中滴入0.10 mol/L的盐酸。溶液的pH与所加盐酸的体积关系如图所示。已知氨水的电离度为1.32%,下列有关叙述正确的是( )
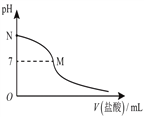
A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0 mL
C. M点处的溶液中![]()
D. N点处的溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,则H3PO2(aq)中离子浓度的顺序为:__________。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银
①H3PO2中,磷元素的化合价为_____
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为___(填化学式);
③NaHPO2为____(填“正盐”或“酸式盐”),其溶液显_____(“弱酸性”,“中性”或“弱碱性”).
(3)H3PO2的工业制法是将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H3PO2),后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:____________。
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):
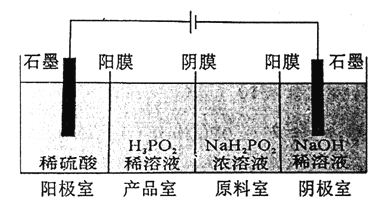
①写出阳极的电极反应式:___________②分析产品室可得到H3PO2的原因:__________
(5)磷酸(H3PO4) 在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
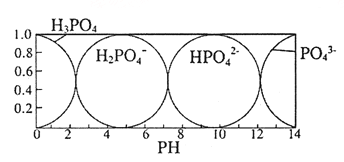
①向Na3PO4溶液中滴入稀盐酸后,pH从10降低到5的过程中发生的主要反应的离子方程式为______。
②从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是_______。(填选项字母)
A、c(Na+) >c(H2PO4-) >c(H+) >c(HPO42-) >c(H3PO4)
B、c(Na+) >c(H2PO4-) >c(OH-)>c(H3PO4) >c(HPO42-)
C、c(H+)+ c(Na+)= c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)+ c(H3PO4)
D、c(Na+)= c(H2PO4-)+c(HPO42-)+c(PO43-)+ c(H3PO4)
③假设在25℃时测得0.1 mol·L-1Na3PO4溶液的pH=12,近似计算出Na3PO4第一步水解的水解常数(用Kh表示) Kh=______mol·L-1(忽略Na3PO4第二、第三步水解,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
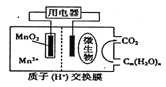
A. 正极反应式为MnO2+4H++2e-===Mn2++2H2O
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池阴极增重9.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应全部生成C2H2Cl4 , 则两个过程中消耗的氯气的总的物质的量是( )
A.3mol
B.4mol
C.5mol
D.6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8 ℃,沸点是44.8 ℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________,试管浸泡在50 ℃的水浴中,目的是___________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:A.3 mol·L-1H2SO4、B.6 mol·L-1NaOH、C.0.5 mol·L-1BaCl2、D.0.5 mol·L-1Ba(NO3)2、E.0.01 mol·L-1酸性KMnO4溶液。(填所选试剂的序号)
检验试剂 | 预期现象和结论 |
装置Ⅲ的试管中加入________ | 产生大量白色沉淀,证明气体产物中含有SO3 |
装置Ⅳ的试管中加入________ | ____________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
(4) 配平离子方程式,并在![]() 中填上所需的微粒:_______________________
中填上所需的微粒:_______________________
H++ MnO4-+ Fe2+→ Mn2+ Fe3++ ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com