
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
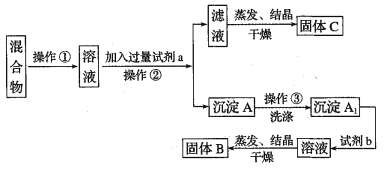
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是______________,试剂a的溶质是_______________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为_____________________________。
(3)该方案有不足之处,请你把它找出来并改进:_______________________________。
(4)操作③为什么要洗涤沉淀A:_____________________________________________。
【答案】过滤 K2CO3 BaCO3 + 2HCl==BaCl2 + CO2 ↑+ H2O 操作②的滤液中K2CO3未除尽,应加入过量的盐酸,再蒸发结晶 洗去沉淀中有残留的KCl 、K2CO3 可溶性杂质
【解析】
分离KCl和BaCl2两种固体混合物,可先溶于水然后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,蒸发结晶得到固体C为KCl和K2CO3,应加入过量盐酸可得KCl,沉淀A为BaCO3,洗涤后,加盐酸,蒸发得到固体B为BaCl2。
(1).将固体配成溶液,应加水溶解,操作②为固体和液体的分离,为过滤操作,固体溶解后加入过量K2CO3使BaCl2转化为沉淀,过滤后沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,则试剂a为K2CO3,试剂b为HCl,固体B为BaCl2,故答案为:过滤;K2CO3;
(2).试剂b为HCl,加入试剂b,BaCO3沉淀加入盐酸可生成BaCl2溶液,反应为BaCO3+ 2HCl=BaCl2+ CO2↑+ H2O,故答案为:BaCO3+ 2HCl=BaCl2+ CO2↑+ H2O;
(3).由上述分析可知,该实验不能达到目的,因操作②的滤液中可能混有碳酸钾,应加过量盐酸后蒸发结晶,故答案为:操作②的滤液中K2CO3未除尽,应加入过量的盐酸,再蒸发结晶;
(4).过滤后的固体表面附着有KCl 、K2CO3可溶性杂质,故答案为:洗去沉淀中有残留的KCl 、K2CO3可溶性杂质。


科目:高中化学 来源: 题型:
【题目】镧系金属元素铈(Ce)常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。铈元素在自然界中主要以氟碳铈矿形式存在,其主要化学成分为CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:

(1)为了提高焙烧效率可以采取的措施有______________。(回答两条即可)
(2)假设参与酸浸反应的CeO2和CeF4的物质的量之比为3∶1,试写出相应的化学方程式: ______。有同学认为酸浸过程中用稀硫酸和H2O2替换盐酸更好,其理由是:___________。
(3)常温下,当溶液中的某离子浓度≤1.0×10-5 mol·L-1时,可认为该离子沉淀完全。据此,在生成Ce(OH)3的反应中,加入NaOH溶液至pH至少达到________时,即可视为Ce3+已完全沉淀。{Ksp[Ce(OH)3]=1.0×10-20}。
(4)向Ce(BF4)3中加入KCl溶液,该反应能发生的原因是____________________。
(5)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,用电解的方法可将上述吸收液中的NO2-转化为稳定的无毒气体,同时将Ce3+再生为Ce4+,其原理如图所示。

①NO2-从电解槽的________(填字母序号)口进入。
②每生成标准状况下11.2 L无毒气体,同时可再生Ce4+________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺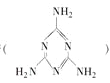 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
A. 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化
B. 一个分子中共含有15个σ键
C. 属于极性分子,故极易溶于水
D. 分子内既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含500mL 0.8 mol/L 的Al2(SO4)3中所含的SO![]() 的物质的量是___________。
的物质的量是___________。
(2)标准状况下,___________ L NH3所含氢原子数与0.2molH3PO4所含氢原子数相等。
(3)将20ml物质的量浓度为6mol/L的MgSO4加水稀释成100ml溶液,所得稀硫酸的物质的量浓度是_____________。
(4)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______________。
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为__________,质量之比为__________。
(6)等质量的 SO2 和 SO3 物质的量之比是____________,氧原子数之比为____________。
(7)25.4 g某二价金属A的氯化物中含有0.4mol Cl-,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于以下反应:A(s)+3B(g)![]() 2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
2C(g)+D(g),在一定温度、压强下,在一体积可变的容器中,当下列物理量不再发生变化时就可确定反应一定达到平衡状态的是
A.容器的体积不再发生变化
B.B的生成速率和D的反应速率之比为3∶1
C.混合气体的密度不随时间变化
D.B、C、D的分子个数之比为3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
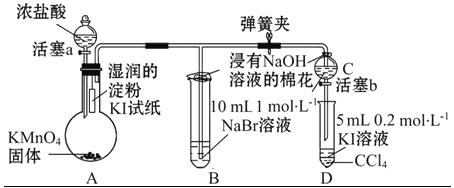
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其电子式是_________________。
(2)验证氯气的氧化性强于碘的实验现象是_____________________________。
(3)B中溶液发生反应的离子方程式是_________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下列装置图成功地实现了CO2和H2O合成CH4。下列叙述错误的是( )

A.电池工作时,实现了将太阳能转化为电能
B.电池内 H+ 透过质子交换膜从左向右移动
C.铜电极为正极,电极反应式为CO2+8H+-8e-=CH4+2H2O
D.为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com