
【题目】实验室中需要配制2molL﹣1 NaOH的溶液450mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是( )
A.500mL,40g
B.500mL,36g
C.450mL,36g
D.450mL,40g
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。下列叙述不正确的是
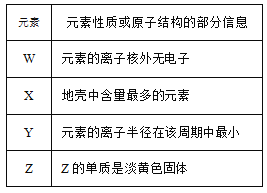
A. W与Z形成的化合物在常温下为气体
B. Y的最高价氧化物对应的水化物显强碱性
C. X和Z形成的常见化合物能形成酸
D. 简单氢化物的稳定性:X > Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Mg、Al混合物投入200mL某浓度的盐酸中,金属完全溶解后,再逐滴加入2mol L-1的NaOH溶液至过量,所生成的沉淀与所加NaOH的关系如图所示。
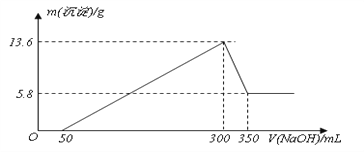
(1)0~50mL段内,发生反应的离子方程式为_________________。
(2)300~350mL段内,发生反应的离子方程式为________________。
(3)试计算该盐酸的浓度___。(写出必要的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)获取铜和胆矾的操作流程如下:

已知:①部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
②B、C均为单一沉淀
请回答下列问题:
(1)已知Cu2O在酸性条件下发生自身氧化还原反应,写出离子反应方程式______________。
(2)为了加快反应I的速率,可以采取的措施是______________(写1点)。
(3)固体混合物A中的成分是__________________________。
(4)反应I完成后,铁元素的存在形式为_______________(填离子符号);写出生成该离子的离子方程式___________________________________。
(5)x对应的数值范围是_______________________。用NaClO调pH,生成沉淀B的反应的离子方程式为____________________________________。
(6)已知:Ksp[Al(OH)3]=1.1×10-33,当调节溶液的pH为5时,c(Al3+)=_________ molL-1
(7)洗涤CuSO4·5H2O粗产品不能用大量水洗,而用冰水洗涤.原因是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于用CCl4萃取碘水的说法中不正确的是( )
A.碘在CCl4中的溶解度大于在水中的溶解度
B.萃取后水层颜色变浅
C.萃取后CCl4溶液层为紫色
D.萃取后水层颜色变红且在下层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成 Hb·CO,使血红蛋白失去输送 O2 功能。CO 进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:
(2)抽烟时,进入肺部的空气中 c(CO)=10-6mol/L,c(O2 )=10-2mol/L,则 c(Hb·CO)为 c(Hb·O2)的 倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02 时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与 c(CO)的比值应大于___________。
II 在某一温度条件下, Bodensteins 研究了反应:2HI(g) ![]() H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度 x(HI)与反应时间 t 的关系如下表:

(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20min,v正=___________·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳的化合物之间很容易发生转化。请回答下列问题:
(1)有机物 M 在有光的时候很容易转化成 N,其过程如下:

M 到 N 过程中,光能转化为 能;其中较稳定的物质是 (用 M、N 回答)。
(1)已知(l)的燃烧热为3267.5kJ·mol-1,
(2)(l)+6O2(g)═6CO2(g)+3H2(g)△H=akJ·mol-1,
则 a -3267.5(填“>”、“<”或“=”)。
(3)在标准状态即压力为 100kPa,一定温度下,由元素最稳定的单质生成生成 1mol 纯化 合物时的反应热称为该化合物的标准摩尔生成焓(△H¢)。已知 100kPa,一定温度下:
Fe2 O 3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+490.0 kJ·mol-1
CO(g)+1/2O2(g)=CO2 (g) △H=-280.0kJ·mol-1
C(石墨)+O 2 ( g)=CO2 (g) △H=-390.5kJ·mol
则 Fe2O3 的标准摩尔生成焓△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将Fe3+转化为Fe2+
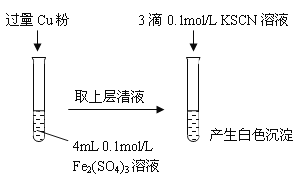
(1)Fe3+与Cu粉发生反应的离子方程式为______________________________。
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案 | 现象 | 结论 |
步骤1:取4mL_______mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
步骤2:取_____________________________ | 无明显现象 |
查阅资料:ⅰ. SCN-的化学性质与I-相似 ⅱ. 2Cu2+ + 4 I-= 2CuI↓+ I2
Cu2+与SCN-反应的离子方程式为_____________________________________。
实验Ⅱ:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2+ + NO ![]() Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
Fe(NO)2+(棕色),3Fe2+ +2[Fe(CN)6]3-= Fe3[Fe(CN)6]2(蓝色)
(3)用离子方程式解释NO 产生的原因_________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应Ⅰ:Fe2+与HNO3反应; 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ__________(填“快”或“慢”)。
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是__________________________________________________________________________。
③已知:在一个已经达到平衡的可逆反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。如:当增加反应物的浓度时,平衡要向正反应方向移动,平衡的移动使得增加的反应物浓度又会逐步减少。
请用上述原理解释溶液由棕色变为黄色的原因________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com