
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的两种方法:______________________、________________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________或H2、________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又 将Br2还原为Br-,其目的为________________________________________________________________________。
将Br2还原为Br-,其目的为________________________________________________________________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________________________________________________________________________,
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是________________________________________________________________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:________________;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为________________________________________________________________________;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________________________________________________________;
④C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是___________________________________。
答案 (1)蒸馏法 电渗析法(其他合理答案也可)
(2)Cl2 NaOH NaClO
(3)富集溴元素
(4)Br2+SO2+2H2O===4H++SO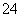 +2Br- 强酸对设备的严重腐蚀
+2Br- 强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶
③控制温度计b的温度,并收集59 ℃时的馏分
④深红棕色 分液(或蒸馏)
解析 (2)从反应2NaCl+2H2O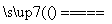 2NaOH+H2↑+Cl2↑可判断出产物,但其中Cl2有可能与NaOH反应生成NaClO。(3)步骤Ⅰ中Br2的浓度很小,若把其中的Br2蒸馏出来,耗能太大,所以要先把Br2富集。(5)③蒸馏的目的,就是通过沸点不同而提纯Br2,所以要把温度控制在Br2的沸点,尽可能只使Br2挥发。
2NaOH+H2↑+Cl2↑可判断出产物,但其中Cl2有可能与NaOH反应生成NaClO。(3)步骤Ⅰ中Br2的浓度很小,若把其中的Br2蒸馏出来,耗能太大,所以要先把Br2富集。(5)③蒸馏的目的,就是通过沸点不同而提纯Br2,所以要把温度控制在Br2的沸点,尽可能只使Br2挥发。


科目:高中化学 来源: 题型:
A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R表示)的单质能与NaOH溶液反应生 成盐(Na2RO3)和氢气。
成盐(Na2RO3)和氢气。
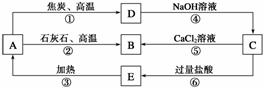
请回答下列问题:
(1)写出各物质的化学式:A__________;B__________;C__________;D__________;E__________。
(2)写出反应①的化学方程式:____________________________________________,
该反应中氧化剂与还原剂的物质的量之比为________。
(3)写出反应④的离子方程式:__________________________________________。
(4)写出反应⑤的离子方程式:___________________________________________。
(5)H2CO3的酸性强于E的,请用离子方程式予以证明:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关的离子方程式或化学方程式中正确的是( )
A.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++HCO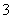 +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
B.磷酸一氢钠溶液水解:HPO +H2OPO
+H2OPO +H3O+
+H3O+
C.将2 mol SO3气体通入一密闭容器中,达平衡后吸收Q kJ热量,则该反应的热化学方程式为2SO3(g)2SO2(g)+O2(g) ΔH=+Q kJ/mol
D.向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充分反应:4Fe2++2Br-+3Cl2===4Fe3++6Cl-+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
A.再通入少量氯气,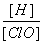 减小
减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有[Na+]=[Cl-]+[ClO-]
D.加入少量水,水的电离平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是 ( )

A.①加CCl4 ②加苯 ③加酒精
B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精
D.①加苯 ②加酒精 ③加CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生 成NaBr、NaBrO
成NaBr、NaBrO 3等
3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是为了避免__________________。
(2)Br2可用热空气吹出,其原因是_________________________________________。
(3)写出步骤③所发生的化学反应方程式____________________________________。
用硫酸而不用盐酸酸化的原因可能是________________。步骤②的产品有时运输到目的地后再酸化,主要是因为___________________________________________________
________________________________________________________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中___________________________。
a.通入HBr b.加入Na2CO3溶液
c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组利用MnO2和浓HCl及如图装置制备Cl2。下列分析中不正确的是( )

A.A中可用分液漏斗代替长颈漏斗
B.A中缺少加热装置
C.B中盛放的NaOH溶液可以净化C l2
l2
D.D中的导管口若连接倒置漏斗可防止倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2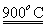 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1。晦K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1。晦K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。

①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列所述变化规律正确的是( )
A.Na、Mg、Al还原性依次增强 B.HCl、PH3、H2S稳定性依次减弱
C.NaOH、KOH、CsOH碱性依次增强 D.S2-、Cl-、K+、Ca2+离子半径依次增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com