
A.在H2C2O4中加入酸性KMnO4溶液: |
B.Ca(HCO3)2与过量Ca(OH)2溶液反应: |
C.用惰性电极电解硫酸铜溶液: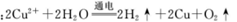 |
D.足量碳酸氢钠溶液与氢氧化钡溶液混合: |
 2Cu+ O2↑+4H+.反应原理错误。D. 足量碳酸氢钠溶液与氢氧化钡溶液混合时应该以Ba(OH)2为标准,反应的化学方程式为Ba(OH)2+2NaHCO3=BaCO3↓+2H2O+Na2CO3。反应原理错误。
2Cu+ O2↑+4H+.反应原理错误。D. 足量碳酸氢钠溶液与氢氧化钡溶液混合时应该以Ba(OH)2为标准,反应的化学方程式为Ba(OH)2+2NaHCO3=BaCO3↓+2H2O+Na2CO3。反应原理错误。

科目:高中化学 来源:不详 题型:单选题
| A.在含Ag+、Cu2+的溶液中加入Zn:Ag+、Cu2+ |
| B.在含Fe3+、Br2的水溶液中滴加KI溶液:Fe3+、Br2 |
| C.在含NH4+、HCO3-的溶液中逐滴加入氢氧化钠溶液:NH4+、HCO3- |
| D.在含[Al(OH)4]-、OH-的溶液中逐滴加入盐酸:[Al(OH)4]-、OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.向40 mL 8 mol/L的硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3— Fe3++NO↑+2H2O Fe3++NO↑+2H2O |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- CaSO3↓+2HClO CaSO3↓+2HClO |
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O HClO+HCO3— HClO+HCO3— |
D.Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2OH-+2H++SO42— BaSO4↓+2H2O BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
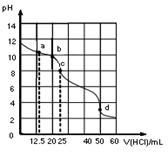
| A.a点:c(CO32-)=c(HCO3-)>c(OH-) |
| B.b点:5c(Cl-)=4c(HCO3-)+4c(CO32-) |
| C.c点:c(OH-)+ c(CO32-)=c(H+)+ c(H2CO3) |
| D.d点:c(Na+)<c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[设其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.将NaHSO3溶于水,溶液呈弱酸性:HSO3—+H2O SO32—+H3O+ SO32—+H3O+ |
| B.工业上用热的纯碱溶液吸收溴蒸气生成溴酸钠:3Br2+3CO32—=5Br-+BrO3—+3CO2 |
| C.明矾溶液中加Ba(OH)2溶液至SO42—完全沉淀:Al3++2SO42—+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
D.用惰性电极电解MgCl2溶液产生气体和白色沉淀:Mg2++2Cl-+2H2O Cl2↑+H2↑+Mg(OH)2↓ Cl2↑+H2↑+Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.新制的氧化铝溶于氢氧化钠溶液:Al2O3+2OH- 2Al 2Al +H2O +H2O |
B.冷的氢氧化钠溶液中通入氯气:Cl2+OH- Cl-+HClO Cl-+HClO |
C.用KIO3氧化酸性溶液中的KI:5I-+I +3H2O +3H2O 3I2+6OH- 3I2+6OH- |
D.硫酸铝溶液中加入过量氨水:Al3++3OH- Al(OH)3↓ Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铁溶液中加入铜粉:2Fe3++Cu===2Fe2++Cu2+ |
| B.向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+===Fe2++2H2O |
| C.硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42—===BaSO4↓ |
| D.向硫酸氢钠溶液中滴加Ba(OH)2溶液至中性:2H++SO42—+Ba2++2OH-===BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com